Medžiagų molekulės nėra visos tiesios, tarsi būtų vienoje plokštumoje. Juk jie yra išsibarstę erdvėje ir jų atomai įgauna skirtingą išsidėstymą ar išsidėstymą. Taigi kiekvienos rūšies medžiagos molekulės turi skirtingas geometrines formas.
Vienas iš paprasčiausių būdų nustatyti molekulės geometriją yra pagrįstas teorija valentinio apvalkalo elektronų porų atstūmimas (RPECV). Pagal šią teoriją centrinio atomo elektronų poros funkcionuoja kaip elektroniniai debesys kurie atstumia vienas kitą. Tokiu būdu jie orientuojasi kuo toliau vienas nuo kito. Molekulinė geometrija priklausys nuo elektroninių porų skaičiaus aplink centrinį atomą.
Šis elektroninis debesis gali būti sudarytas iš elektronų, kurie dalyvauja ryšiuose (viengubai, dvigubi arba trigubi), taip pat nedalyvaujantys. Taigi mes turime:
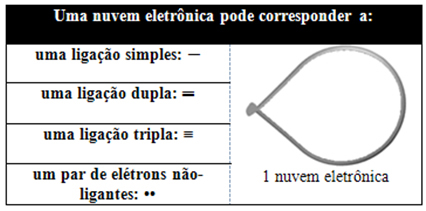
Tai padeda įsivaizduoti šį debesį kaip pririštą balioną ar balionus, kurių centre yra centrinis atomas. Pavyzdžiui, molekulėje, kurioje aplink centrinį atomą yra tik du elektronų debesys, tuo didesnis galimas atstumas tarp jų yra 180º kampas, todėl molekulės geometrija bus linijinis.
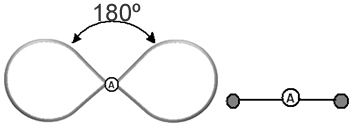
Todėl galime daryti išvadą apie tai, kokia bus daugumos molekulių molekulinė geometrija, jei atsižvelgsime į atomų skaičius molekulėse ir centrinio atomo ryšiai, tikrinant, ar jis turi porų, ar ne elektronų.
Žiūrėkite toliau pateiktus pavyzdžius:
- Molekulės su 2 atomais: visada bus linijinis
Pavyzdžiui:
H ─ H, H ─ Cl, F ─ F, O ═ O, C ≡ O.
Nesustok dabar... Po reklamos yra daugiau ;)
- 3 atomų molekulė: kampinis arba trikampis
jei centrinis atomas turi porą nesurišančių elektronų geometrija bus kampinis, kaip ir SO molekulės atveju2:
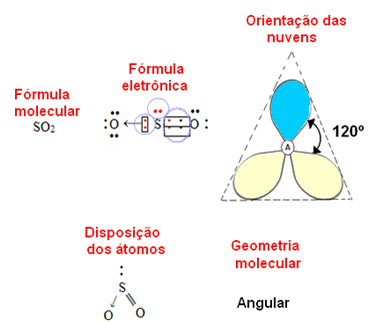
Laikykite, kad mėlynas elektronų debesis reiškia elektronų poras, kurios nedalyvauja ryšiuose, o geltonas - elektronų poras, kurios dalyvauja ryšiuose.
- 4 atomų molekulė: plokštuminė trikampė (arba trikampė) arba piramidinė (arba trikampė piramidė)
Jei centrinis atomas neturi nesuporuotos (nesiejančios) elektronų poros, molekulinė geometrija yra plokščia trikampė (arba trikampė). Pažvelkite į BF pavyzdį3:

Jei atomas turi nesurišančių elektronų porų, molekulės geometrija bus piramidinė (arba trigoninė piramidė), kaip ir amoniako atveju:

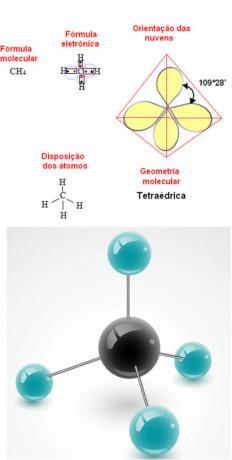
- 5 atomų molekulė: tetraedrinis
Metano geometrijos pavyzdys:
- 6 atomų molekulė: trikampė bipiramidė arba trikampė piramidė.
Pavyzdys yra fosforo pentachloridas (PCl5), kuris turi tam tikrų jungčių tarp fosforo ir chloro 90º kampu, o kitus 120º kampu, sudarydamas bipiramidę su trikampiu pagrindu:
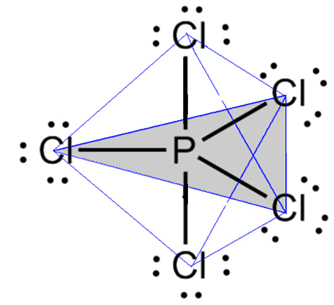
- 7 atomų molekulė: oktaedrinė
Pavyzdys: sieros heksafluoridas (SF6), kurių kampai yra 90º.

Autorius Jennifer Fogaça
Baigė chemiją
Ar norėtumėte remtis šiuo tekstu mokykloje ar akademiniame darbe? Žiūrėk:
FOGAÇA, Jennifer Rocha Vargas. „Molekulių geometrijos nustatymas“; Brazilijos mokykla. Galima įsigyti: https://brasilescola.uol.com.br/quimica/determinacao-geometria-das-moleculas.htm. Žiūrėta 2021 m. liepos 27 d.



