Kaip rodo jo pavadinimas, jonai jungiasi tarp jonų. Kadangi jie turi priešingus krūvius, katijonai (elementas, turintis teigiamą krūvį) ir anijonai (elementas, turintis neigiamą krūvį) traukia elektrostatiškai vienas kitą, formuodami ryšį. Tačiau joninę kietąją medžiagą sudaro katijonų ir anijonų aglomeratas, susidedantis iš tiksliai apibrėžtų geometrinių formų, vadinamų grotelėmis arba kristalinėmis grotelėmis.
Pvz., Druska (natrio chloridas) susidaro galutinai perkėlus elektroną iš natrio į chlorą, gaunant natrio katijoną (Na+) ir chlorido anijoną (Cl-). Praktiškai ši reakcija apima ne tik du atomus, bet ir didžiulį ir neapibrėžtą skaičių atomų, kurie sudaro kubo formos kristalinę grotelę, kaip parodyta žemiau:
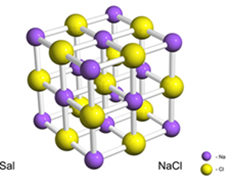
Jei pažvelgsime į druskos kristalus nuskaitymo elektroniniu mikroskopu, pamatysime, kad jie iš tikrųjų yra kubiniai dėl savo vidinės struktūros.

Kadangi kiekvienas joninis junginys susideda iš neapibrėžto ir labai daug jonų, kaip mes galime pavaizduoti joninį junginį?
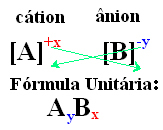
Paprastai naudojama formulė yra
vieneto formulė, kuris yra tas, kuris reiškia proporciją, išreikštą kuo mažesniu katijonų ir anijonų, sudarančių kristalinę gardelę, skaičiumi, todėl visas junginio krūvis neutralizuojamas. Kad tai įvyktų, būtina, kad atomo atiduotas elektronų skaičius būtų lygus kito atomo gaunamų elektronų skaičiui.Kai kurie joninių junginių formulės aspektai yra svarbūs, žr.
Nesustokite dabar... Po reklamos dar daugiau;)
- Visada pirmiausia parašykite katijoną, tada - anijoną;
- Kadangi kiekvienas joninis junginys yra elektriškai neutralus, atskirų jonų krūvių nereikia užrašyti;
- Kiekvieno jono dešinėje pusėje rodomi indeksų skaičiai rodo katijono atomų ir anijono santykį. Šie skaičiai vadinami indeksais, o skaičius 1 nerašomas.
Pavyzdžiui, natrio chlorido atveju jo vieneto formulė yra NaCl, nes kiekvienam chlorido anijonui turime tiksliai 1 natrio katijoną.
Pažiūrėk kitą pavyzdį Al3+ turi tris teigiamus krūvius, tuo tarpu F- jis turi tik vieną neigiamą, todėl junginiui neutralizuoti reikalingi trys fluoro anijonai. Taigi darome išvadą, kad jo vieneto formulė yra AlF3.
Paprastas būdas gauti joninio junginio vieneto formulę yra jo krūvių mainai į indeksus, kaip parodyta toliau bendruoju būdu:
Pavyzdžiai:

Kita joninėms medžiagoms apibūdinti naudojama formulė yra Lewiso formulė arba elektroninė formulė, ką reiškia elektronus iš „kamuoliukų“ jonų valentinio apvalkalo aplink elemento simbolį. Druskos atveju turime:

Jennifer Fogaça
Baigė chemiją
Ar norėtumėte paminėti šį tekstą mokykloje ar akademiniame darbe? Pažvelk:
FOGAÇA, Jennifer Rocha Vargas. „Joninių obligacijų atvaizdavimo formulės“; Brazilijos mokykla. Yra: https://brasilescola.uol.com.br/quimica/formulas-para-representar-as-ligacoes-ionicas.htm. Žiūrėta 2021 m. Birželio 28 d.
b) Nustatykite x reikšmę natrio aliuminio fluorido formulėje.
Joninių junginiai, pagrindinės joninių junginių charakteristikos, jungimasis tarp jonų, galutinis elektronų perdavimas, elektrostatinės traukos jėgos tarp jonų, neigiamų ir teigiamų jonų, anijonų, katijonų, joninių jungčių, molekulinės struktūros jis
Anglies erdvinė formulė, Lewiso elektroninė formulė, plokštumos struktūra, elektroninės poros, ryšys kovalentinis, valentinis sluoksnis, atomo modelio raida, molekulinė formulė, struktūrinė formulė, formulės trimatis.
Cheminės formulės, plokščios struktūrinės formulės, jungties struktūrinė formulė, triguba jungtis, dujos azotas, elektroninė formulė, Lewiso formulė, molekulinė formulė, viengubas ryšys, dvigubas ryšys, dujos anglies.
Chemija

Joninis ryšys, joninių junginių, joninių aglomeratų, natrio chlorido, valgomosios druskos, joninės medžiagos, elektrostatinės traukos jėgos, chlorido anijonai, natrio katijonai, poliniai tirpikliai, teigiami jonai, katijonai, neigiami jonai, anijonai.