Periodinė lentelė yra svarbi tyrimo priemonė, kaupianti informaciją apie visus žinomus cheminius elementus.
Patikrinkite savo žinias naudodami šį sąrašą 17 klausimų su skirtingais požiūriais į šią temą ir išspręskite abejones rezoliucijomis, pakomentuotomis po atsiliepimų.
Norėdami lengviau suprasti klausimus, naudokite Periodinė elementų lentelė baigta ir atnaujinta.
Periodinių lentelių organizavimas
Klausimas 1
(NSO) XIX amžiaus pradžioje atradus ir išskyrus įvairius cheminius elementus, reikėjo juos racionaliai klasifikuoti, kad būtų galima atlikti sistemingus tyrimus. Buvo pridėta daugybė įnašų, kol pasiekiama dabartinė periodinė cheminių elementų klasifikacija. Dėl dabartinės periodinės klasifikacijos atsakykite:
a) Kaip periodiškai išvardyti elementai paeiliui?
Periodinė lentelė yra suskirstyta į cheminių elementų sekas didėjančia tvarka atominis skaičius. Šis skaičius atitinka protonų skaičių atomo branduolyje.
Šį organizavimo būdą pasiūlė Henry Moseley, kai jis pertvarkė Dmitrijaus Mendelejevo pasiūlytą lentelę.
Elementą lentelėje gali išdėstyti šeima ir laikotarpis, į kurį jis įterpiamas. Šis pasiskirstymas įvyksta taip:
| grupės ar šeimos | 18 vertikalių sekų |
| Elementų grupės, turinčios panašių savybių. |
| Laikotarpiai | 7 horizontalios sekos |
| Elemento elektroninių sluoksnių skaičius. |
b) Kurias periodinės lentelės grupes galima rasti: halogeną, šarminį metalą, šarminį žemės metalą, chalkogeną ir kilmingąsias dujas?
Elementai skirstomi į grupes pagal savybes. Elementai, priklausantys tai pačiai grupei, turi panašias charakteristikas ir pagal pateiktą klasifikaciją turime:
| klasifikacija | Grupė | Šeima | Elementai |
| halogenas | 17 | 7A | F, Cl, Br, I, At ir Ts |
| šarminis metalas | 1 | 1A | Li, Na, K, Rb, Cs ir Fr |
| šarminis žemės metalas | 2 | 2A | Būkite, Mg, Ca, Sr, Ba ir Ra |
| chalkogenas | 16 | 6A | O, S, Se, Te, Po ir Lv |
| tauriųjų dujų | 18 | 8A | Jis, Ne, Ar, Kr, Xe, Rn ir Og |
2 klausimas
(PUC-SP) Išspręskite problemą, remdamiesi toliau pateiktų teiginių analize.
I - Dabartinė šiuolaikinė periodinė lentelė yra išdėstyta didėjančia atominės masės tvarka.
II - visi elementai, kurių valentiniame apvalkale yra 1 elektronas ir 2 elektronai, yra atitinkamai šarminių metalų ir šarminių žemių metalų, jei pagrindinis kvantinis skaičius šio sluoksnio (n 1).
III - Tuo pačiu laikotarpiu elementai pateikia tiek pat lygių (sluoksnių).
IV - toje pačioje grupėje (šeimoje) elementai turi tą patį lygių (sluoksnių) skaičių.
Padaryta išvada, kad, atsižvelgiant į dabartinę periodinę cheminių elementų lentelę, jie yra teisingi:
a) I ir IV (tik).
b) I ir II (tik).
c) II ir III (tik).
d) II ir IV (tik).
e) III ir IV (tik).
Teisinga alternatyva: c) II ir III (tik).
Analizuodami kiekvieną alternatyvą turime:
Aš - NETEISINGAI. Elementai yra išdėstyti didėjančia atominio skaičiaus tvarka.
II - TEISINGA. Valentinio apvalkalo elektronai apibrėžia grupę, kurioje yra elementas.
| šarminiai metalai | 1 elektronas valentiniame apvalkale |
| 3skaityti | 2-1 |
| 11At | 2-8-1 |
| 19K. | 2-8-8-1 |
| 37Rb | 2-8-18-8-1 |
| 55Cs | 2-8-18-18-8-1 |
| 87Kun | 2-8-18-32-18-8-1 |
| šarminių žemių metalai | 2 elektronai valentiniame apvalkale |
| 4būti | 2-2 |
| 12mg | 2-8-2 |
| 20Čia | 2-8-8-2 |
| 38Ponas | 2-8-18-8-2 |
| 56Ba | 2-8-18-18-8-2 |
| 88Varlė | 2-8-18-32-18-8-2 |
Pagrindinis kvantinis skaičius atitinka apvalkalą, kuriame yra elektronas, skiriasi nuo 1, nes elektroniniu platinimu pastebime, kad elektrono vieta yra nuo antrojo apvalkalo arba n = 2.
III - TEISINGA. Elemento vieta tam tikru laikotarpiu atsiranda dėl sluoksnių skaičiaus atliekant elektroninį platinimą.
| Laikotarpiai | 7 horizontalios sekos |
| 1-asis laikotarpis | 1 sluoksnis: K. |
| 2-asis laikotarpis | 2 sluoksniai: K, L |
| 3-asis laikotarpis | 3 sluoksniai: K, L, M |
| 4-asis laikotarpis | 4 sluoksniai: K, L, M, N |
| 5-asis laikotarpis | 5 sluoksniai: K, L, M, N, O |
| 6-asis laikotarpis | 6 sluoksniai: K, L, M, N, O, P |
| 7-asis laikotarpis | 7 sluoksniai: K, L, M, N, O, P, Q |
Pavyzdys: cheminis elementas, esantis antrame laikotarpyje.
IV - NETEISINGAI. Elementai, priklausantys tai pačiai grupei, turi panašias savybes ir taip yra dėl to, kad valentiniame apvalkale jie turi tą patį elektronų skaičių.
Pavyzdys:
| Berilis | Magnis |
|
2 elektronai valentinis sluoksnis. |
2 elektronai valentinis sluoksnis. |
Todėl berilis ir magnis yra periodinės lentelės 2 grupės dalis.
3 klausimas
(Unitins) Dėl šiuolaikinės periodinės elementų klasifikacijos nurodykite tikrąjį teiginį:
a) šeimoje elementų paskutiniame apvalkale paprastai yra vienodas elektronų skaičius.
b) periodinėje lentelėje cheminiai elementai dedami mažėjančia atominių masių tvarka.
c) šeimoje elementai turi labai skirtingas chemines savybes.
d) per vieną laikotarpį elementai turi panašias chemines savybes.
e) visi tipiniai elementai priklauso periodinės lentelės B grupei.
Teisinga alternatyva: a) šeimoje elementai paskutiniame apvalkale paprastai turi tą patį elektronų skaičių.
a) TEISINGA. Tos pačios šeimos cheminių elementų paskutiniame apvalkale yra vienodas elektronų skaičius, todėl jie turi panašias savybes.
b) NETEISINGAI. Atominės masės didėja didėjant elemento atominiam skaičiui.
c) NETEISINGAI. Cheminės elementų savybės yra panašios, todėl jie yra sugrupuoti į tą pačią šeimą.
d) NETEISINGAI. Vienu metu elementų elektronai pasiskirstę tame pačiame lukštų skaičiuje.
e) NETEISINGAI. Reprezentatyvūs elementai priklauso A grupei, kuri atitinka šeimas: 1A, 2A, 3A, 4A, 5A, 6A, 7A ir 8A. B grupei priklausantys elementai yra pereinamieji elementai.
4 klausimas
(Vunesp) Atsižvelgiant į cheminių elementų savybes ir periodinę lentelę, neteisinga teigti:
a) metalas yra medžiaga, kuri praleidžia elektros srovę, yra plastiška ir kalioji.
b) nemetalas yra medžiaga, kuri neveda elektros srovės, nėra plastiška ir kalioji.
c) semimetalas turi fizinę metalo išvaizdą, tačiau cheminė savybė yra panaši į nemetalo.
d) daugumą cheminių elementų sudaro nemetalai.
e) tauriosios dujos yra monoatominės.
Neteisinga alternatyva: d) dauguma cheminių elementų yra nemetalai.
Atkreipkite dėmesį į cheminių elementų klasifikaciją periodinėje lentelėje į metalus, nemetalus ir pusmetlius.

Kaip matome, dauguma elementų yra metalai.
a) TEISINGA. Metalai praleidžia elektrą dėl laisvų elektronų suformuotų elektronų debesų, kurie būdingi jų struktūrai. Jie yra plastiški, nes gali virsti laidais ar lakštais, priklausomai nuo regiono, kuriame daromas slėgis. Jie taip pat yra kaliojo, nes iš šios rūšies medžiagos galima gaminti labai plonus lakštus.
b) TINKAMA. Nemetalai turi priešingas metalų savybes. Vietoj laidininkų jie yra geri šilumos izoliatoriai ir, kadangi yra trapūs, jie nėra suformuoti į laidus ar lakštus, nes jie nėra gero plastiškumo ir kaliojo.
c) TINKAMA. Semimetalai pasižymi tarpinėmis metalų ir nemetalų savybėmis. Būdami puslaidininkiai elektros energijai, jie turi metalinį blizgesį, tačiau yra trapūs kaip nemetalai.
d) NETEISINGAI. Dauguma elementų priskiriami metalams. Metalų klasės, esančios periodinėje lentelėje, yra: šarminis, šarminis žemė, pereinamasis vidinis ir išorinis.
e) TEISINGA. Tauriosios dujos yra monoatominės, todėl jas vaizduoja tik jų inicialai.
Pavyzdys:
| tauriųjų dujų | chalkogenas |
| Helis (jis) | Deguonis (O2) |
| monoatominis: susidaro atomas | diatominis: susidaro iš dviejų atomų |
Dėl tauriųjų dujų stabilumo šios šeimos elementai turi mažą reaktyvumą ir dar vadinami inertiškais.
5 klausimas
Apie dabartinės periodinės lentelės organizavimą atsakykite:
a) Kas yra stulpeliai?
b) Kokios yra linijos?
c) Koks metodas naudojamas organizuoti cheminius elementus?
Atsakymai:
a) stulpeliai yra periodinės lentelės grupės, anksčiau vadintos šeimomis, sujungiančios panašių savybių cheminius elementus.
b) Linijos yra periodinės lentelės periodai ir nurodo pagrindinės būsenos atomo elektroninių sluoksnių skaičių.
c) Dabartinėje periodinėje lentelėje esantys cheminiai elementai yra išdėstyti didėjančia atomo skaičiaus tvarka, nurodančia protonų skaičių atomo branduolyje.
Periodinės lentelės šeimos
Klausimas 1
(CESGRANRIO) Susiejant žemiau esančius stulpelius, kurie pagal periodinę lentelę atitinka elementų šeimas, skaitmeninė seka bus tokia:
| 1. tauriųjų dujų | • 1A grupė |
| 2. šarminiai metalai | • 2A grupė |
| 3. šarminių žemių metalai | • 6A grupė |
| 4. Chalkogenai | • 7A grupė |
| 5. Halogenai | • 0 grupė |
a) 1, 2, 3, 4, 5.
b) 2, 3, 4, 5, 1.
c) 3, 2, 5, 4, 1.
d) 3, 2, 4, 5, 1.
e) 5, 2, 4, 3, 1.
Teisinga alternatyva: b) 2, 3, 4, 5, 1.
| grupės | elektroninė konfigūracija |
| • 1A grupė: 2. šarminiai metalai | mus1 (su n |
| • 2A grupė: 3. šarminių žemių metalai | mus2 (su n |
| • 6A grupė: 4. Chalkogenai | mus2np4 |
| • 7A grupė: 5. Halogenai | mus2np5 |
| • 0 grupė: 1. tauriųjų dujų | 1s2 (Jis) ar mes2np6 (jei n> 1) |
2 klausimas
(UECE) Cheminio elemento, kurio Z = 54, valentiniame sluoksnyje yra 5s konfigūracija2 5p6. Elementai, kurių Z = 52 ir Z = 56, priklauso:
a) chalkogenai ir šarminė žemė
b) halogenai ir šarmai
c) halogenai ir šarminė žemė
d) chalkogenai ir šarmai
Teisinga alternatyva: a) chalkogenai ir šarminės žemės.
Atsižvelgdami į atominius skaičius, mes atlikome elektroninį paskirstymą ir radome šiuos rezultatus:
| 54X ir | 52Tu | 56Ba |
|
8 elektronai valentinis sluoksnis |
6 elektronai valentinis sluoksnis |
2 elektronai valentinis sluoksnis |
| Tauriosios dujos: 8A šeima | Chalkogenai: 6A šeima | Šarminė žemė: 2A šeima |
3 klausimas
(F. Ibero-Americana-SP) Periodinės lentelės grupė, kuriai būdingas dirbtinių elementų vyravimas, yra tokia:
a) lantanidai
b) tauriųjų dujų
c) pereinamieji metalai
d) šarminiai žemės metalai
e) aktinidai
Teisinga alternatyva: e) aktinidai.
Dirbtiniai elementai yra tie, kurių gamtoje nėra ir kurie buvo sintetinti laboratorijoje per branduolines reakcijas.
Jie taip pat vadinami transuraniniais elementais, nes šių radioaktyviųjų elementų atominis skaičius yra didesnis nei 92, kuris atitinka uraną.
Apskritai šie elementai yra trumpalaikiai, trunkantys iki sekundės dalių.
Pagal šią informaciją turime:
Gamtoje randami tokie elementai: lantanidai, tauriosios dujos, pereinamieji metalai ir šarminiai žemių metalai. Išskyrus dirbtinį technecį ir prometį.
Dirbtinių elementų vyrauja aktinidai, priskiriami vidiniams pereinamiesiems metalams ir įterpiami į periodinę lentelę po lantanidais. Iš šios serijos natūralūs yra tik aktiniumas, toris, protaktinas ir uranas.
4 klausimas
(U. Salvadoro katalikų bažnyčia-BA) X rūšis2- su 8 elektronais išoriniame apvalkale (valentiniame apvalkale) jis gali būti iš elemento X, kuris periodinėje lentelėje priklauso grupei:
a) 7A
b) 6A
c) 2A
d) 1A
e) 8A
Teisinga alternatyva: b) 6A.
Pagal okteto taisyklę, norint, kad elementas įgautų stabilumą, jis prisiima elektroninę tauriųjų dujų konfigūraciją, kurios valentiniame apvalkale yra 8 elektronai.
2 mokestis už X rūšį2- rodo, kad elementas įgijo 2 elektronus.
Rūšių, turinčių 8 elektronus tolimiausiame apvalkale, elektronų konfigūracija yra ns2np6.
Praradęs du elektronus, elementas grįžta į savo pagrindinę būseną su ns elektronų konfigūracija2np4.
6 elektronai, esantys valentiniame apvalkale, būdingi chalkogenams, 6A šeimos elementams.
Pavyzdžiui:
| Elementas: deguonis | elektroninė konfigūracija |
| 8O | 1s22s22p4 |
| rūšis O2- | 1s22s22p6 |
Išmokti daugiau apie Periodinės lentelės šeimos.
Cheminiai elementai
Klausimas 1
Atsižvelgiant į 3, 9, 11, 12, 20, 37, 38, 47, 55, 56 ir 75 atomų skaičių elementus, yra tik šarminių metalų pasirinkimas:
a) 3, 11, 37 ir 55
b) 3, 9, 37 ir 55
c) 9, 11, 38 ir 55
d) 12, 20, 38 ir 56
e) 12, 37, 47 ir 75
Teisinga alternatyva: a) 3, 11, 37 ir 55
Šarminiai metalai atitinka cheminius elementus, kurie elektroninį pasiskirstymą baigia elektronu s pakopoje.
Elektroniškai paskirstydami nurodytus atominius skaičius, turime šiuos šarminius metalus:
| Z = 3 | Z = 11 | Z = 37 | Z = 55 |
| Ličio | Natris | Rubidiumas | Cezis |
Kiti atominiai skaičiai atitinka šių grupių elementus:
Šarminių žemių metalai: nutraukia elektroninį paskirstymą pakopose2.
| Z = 12 | Z = 38 | Z = 56 |
| Magnis | Stroncio | Bariumas |
Pereinamieji metalai: nutraukite elektroninį platinimą d pakopoje.
| Z = 30 | Z = 47 | Z = 75 |
| Cinkas | sidabras | Renis |
Halogenai: nutraukia elektroninį platinimą po lygiu p5.
| Z = 9 |
2 klausimas
(„Unirio“) „Dirbtinė širdis, dedama į„ Eloi “, buvo pradėta kurti prieš ketverius metus JAV ir ja jau naudojasi maždaug 500 žmonių. Rinkinį, vadinamą „Heartmate“, sudaro trys pagrindiniai kūriniai. Svarbiausias yra keturių svarų apvalus maišas, 12 cm skersmens ir 3 cm storio, pagamintas iš titano - sidabro-balto metalo, lengvo ir stipraus “. Žurnalas „Veja“, 1999 m. Liepos mėn.
Tarp žemiau esančių metalų, kurio paskutiniame sluoksnyje elektronų skaičius yra lygus titano skaičiui, yra:
a) C
b) Į
c) Ga
d) Mg
e) Xe
Teisinga alternatyva: d) Mg.
| Titanas | elektroninė konfigūracija | Sluoksnių pasiskirstymas |
| 22Tu | 1s2 2s2 2p6 3s2 3p6 4s2 3d2 | 2, 8, 10, 2 |
Iš elektroninio titano paskirstymo matome, kad šio elemento paskutiniame apvalkale yra 2 elektronai.
| Elementas | elektroninė konfigūracija | Sluoksnių pasiskirstymas |
| 6Ç | 1s2 2s2 2p2 | 2, 4 |
| 11At | 1s2 2s2 2p6 3s1 | 2, 8, 1 |
| 31Ga | 1s2 2s2 2p6 3s2 3p6 4s2 3d104p1 | 2, 8, 18, 3 |
| 12mg | 1s2 2s2 2p6 3s2 | 2, 8, 2 |
| 54X ir | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 | 2, 8, 18, 18, 8 |
Elementas, kurio paskutiniame apvalkale taip pat yra 2 elektronai, yra magnis.
3 klausimas
Apsvarstykite tam tikrą cheminį elementą, kurio energingiausias pakopas yra 5s2. Jo atominis skaičius ir grupė, kurioje jis yra periodinėje lentelėje, yra atitinkamai:
a) 20; 1A
b) 20; 2A
c) 38; 2A
d) 38; 1A
e) 39; 2A
Teisinga alternatyva: c) 38; 2A
Atlikdami elektroninį platinimą nustatėme, kad:
- Cheminis elementas yra šeimoje 2A, nes jis turi energingiausią pakopą s2
- Turi atominį skaičių 38, kuris atitinka bendrą paskirstytų elektronų skaičių.
- Jis yra penktame laikotarpyje, nes elektroninis platinimas buvo vykdomas iki penkto sluoksnio.
Patikrinę šią informaciją periodinėje lentelėje, galime patvirtinti, kad tai yra stroncio elementas.
4 klausimas
(UFC) x atomas turi dar vieną protoną nei y atomas. Remdamiesi šia informacija, nustatykite teisingą teiginį.
a) Jei y yra šarminė žemė, x yra šarminis metalas.
b) Jei y yra tauriosios dujos, x yra halogenas.
c) Jei y yra pereinamasis metalas, x yra tauriosios dujos.
d) Jei y yra tauriosios dujos, x yra šarminis metalas.
e) periodinėje lentelėje x yra tuo pačiu laikotarpiu prieš atomą y.
Teisinga alternatyva: d) Jei y yra tauriosios dujos, x yra šarminis metalas.
Periodinė lentelė yra išdėstyta didėjančia atominio skaičiaus tvarka.
Jei Y turi atominį skaičių z, o X turi dar vieną protoną, nei jis, tai reiškia, kad šie du elementai yra tame pačiame laikotarpyje, o X yra po Y.
Pavyzdys:
| Elementas | vėlesnis elementas |
| zY | z + 1X |
| 11At | 12mg |
Du elementai yra 3-ajame laikotarpyje, o magnis turi dar vieną protoną nei natris.
Pagal šį samprotavimą turime:
a) NETEISINGAI. Šarminis metalas yra prieš periodinio stalo šarminį žemę. Teisingas teiginys būtų toks: jei y yra šarminis metalas, x yra šarminis žemė.
b) NETEISINGAI. Halogenas yra prieš periodines lenteles esančias taurąsias dujas. Teisingas teiginys būtų toks: jei y yra halogenas, x yra tauriosios dujos.
c) NETEISINGAI. Pereinamieji metalai ir tauriosios dujos yra atskirti kitais cheminiais elementais, todėl nėra nuoseklūs.
d) TEISINGA. Tauriosios dujos yra paskutinė periodinės lentelės grupė, o šarminiai metalai - pirmieji, todėl jie yra nuoseklūs.
Pavyzdys:
| tauriųjų dujų | šarminis metalas |
| zY | z + 1X |
| 2jis | 3skaityti |
Ličio, šarminio metalo, protonas yra daugiau nei helio, kuris yra tauriųjų dujų.
e) NETEISINGAI. X yra tuo pačiu laikotarpiu kaip Y, bet po jo ne anksčiau kaip alternatyva.
5 klausimas
Pagal cheminio elemento atominį skaičių galima sužinoti:
a) neutronų skaičius branduolyje
b) elektronų skaičius elektrosferoje
c) šerdies masė
Atsakymas: b) elektronų skaičius elektrosferoje
Pagrindinės būsenos atomas yra elektra neutralus. Taigi, žinodami atominį skaičių, kuris atitinka protonų (teigiamai įkrautų dalelių) skaičių, žinome elektronų (neigiamai įkrautų dalelių) skaičių elektrosferoje.
Pavyzdžiui, geležis turi atominį skaičių 26, taigi, esant pagrindinei būsenai, aplink branduolį yra 26 elektronai.
Išmokti daugiau apie cheminiai elementai tai atominis skaičius.
Periodinės ir aperiodinės savybės
Klausimas 1
(UFSM) Spręskite, ar teiginiai, susiję su periodinėmis elementų savybėmis, yra teisingi (T) ar klaidingi (F).
() Priklauso nuo elementų atominės masės.
() Jie kartojami daugiau ar mažiau reguliariais intervalais, atsižvelgiant į atomų skaičiaus padidėjimą.
() Yra panašūs toje pačioje elementų grupėje.
() Yra panašūs tuo pačiu elementų laikotarpiu.
() Toje pačioje grupėje periodinių savybių skaitinės vertės visada didėja, kai padidėja elementų atominis skaičius.
Teisinga seka yra:
a) V - F - V - F - F
b) V - F - F - V - V
c) F - V - V - F - F
d) F - V - F - V - V
e) V - F - F - V - F
Teisinga alternatyva: c) F - V - V - F - F
(NETIESA) Priklauso nuo elementų atominės masės.
Pagal Moseley periodiškumo dėsnį, daugelis fizinių ir cheminių cheminių elementų savybių skiriasi pagal atominį skaičių.
(TIESA) Jie kartojami daugmaž reguliariais intervalais, atsižvelgiant į atomų skaičiaus padidėjimą.
Tokios savybės kaip atomo spindulys, atomo tūris, tankis, lydymosi temperatūra ir virinimas yra savybių, kurios periodinėje lentelėje reguliariai kartojasi, pavyzdžiai.
(TIESA) Yra panašūs toje pačioje elementų grupėje.
Periodinės lentelės grupės buvo išdėstytos elementais, turinčiais panašias savybes.
(NETIESA) Yra panašūs tuo pačiu elementų laikotarpiu.
Savybės šeimose yra panašios, o ne laikotarpiai. Laikotarpiais elementai paskirstomi pagal elektroninių sluoksnių skaičių.
(NETIESA) Toje pačioje grupėje periodinių savybių skaitinės vertės visada didėja, kai padidėja elementų atominis skaičius.
Savybės gali padidėti arba sumažėti, priklausomai nuo atominio skaičiaus. To pavyzdys yra elektronegatyvumas, kuris mažėja didėjant atomo skaičiui tam tikroje grupėje.
Taip pat skaitykite: Periodinės savybės
2 klausimas
(FAESP) Aperiodinės elementų savybės yra šios:
a) tankis, atominis tūris ir atominė masė.
b) lydymosi temperatūra, elektronegatyvumas ir savitoji šiluma.
c) atominis tūris, atominė masė ir lydymosi temperatūra.
d) atominė masė, savitoji šiluma ir lydymosi temperatūra.
e) atominė masė ir savitoji šiluma.
Teisinga alternatyva: e) atominė masė ir savitoji šiluma.
Aperiodinės savybės kartojamos reguliariais intervalais.
Atominė masė yra atomo svorio matas atominės masės vienetais, kuris atitinka anglies-12 masės.
Specifinė šiluma nustato šilumos kiekį, reikalingą 1 g elemento temperatūrai padidinti 1 ° C.
Šios dvi savybės nėra susijusios su elemento padėtimi periodinėje lentelėje.
Kitos savybės priskiriamos periodinėms, nes jos didėja arba mažėja priklausomai nuo atominio skaičiaus. Ar jie:
- Tankis: rodo elemento masės ir tūrio koeficientą.
- Atomo tūris: nurodo atomų rinkinio tūrį ir įtakoja atstumą tarp jų.
- Lydymosi temperatūra: temperatūra, kuriai esant pereinama iš kieto į skystą.
- Elektronegatyvumas: atomo gebėjimas pritraukti elektroninę porą, kurią jis dalijasi kovalentiniu ryšiu.
Taip pat skaitykite: elektronegatyvumas ir Elektroninis bendrumas
3 klausimas
Kurios iš šių schemų, susijusių su periodine lentele, yra teisingos?
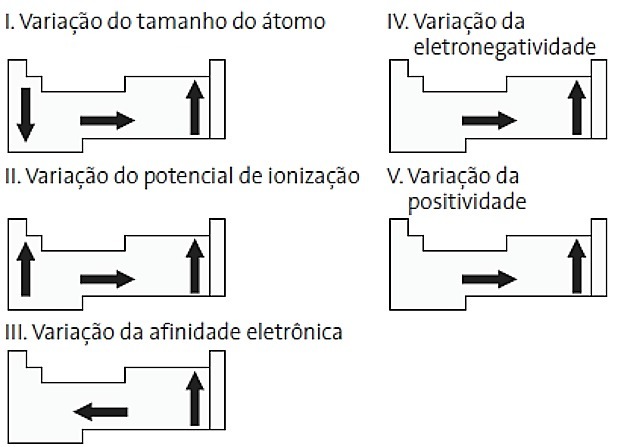
a) II ir V
b) II ir III
c) Aš ir V
d) II ir IV
e) III ir IV
Teisinga alternatyva: d) II ir IV.
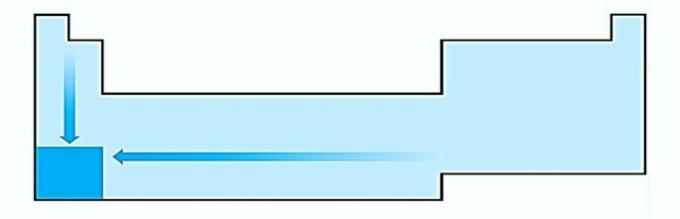
Aš NETEISINGAI. Atomo dydžio kitimas matuojamas vidutiniu atstumu nuo branduolio iki tolimiausio elektrono. Didžiausi atomai yra lentelės apačioje, todėl padidėjimas vyksta pagal atominį skaičių ir teisingas atvaizdavimas yra:
II. TEISINGA Energija, reikalinga elektronui nuplėšti nuo izoliuoto atomo dujinėje būsenoje, vadinama jonizacijos potencialu. Jis didėja, kaip parodyta teiginių diagramoje.
III. NETEISINGAI. Elektroninis giminingumas išreiškia energiją, išsiskiriančią, kai neutralus dujinės būsenos atomas gauna elektroną, kuris yra labai svarbi nemetalų savybė. Didžiausias elektroninis afinitetas pastebimas halogenuose ir deguonyje.
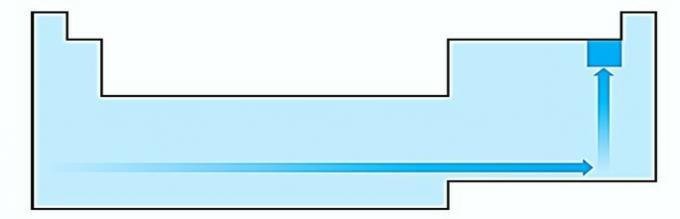
IV. TEISINGA Elektronegatyvumas yra susijęs su jonizacijos potencialu ir elektronų afinitetu. Kaip tokie, halogenai yra labiausiai elektronegatyvūs elementai periodinėje lentelėje.
V. NETEISINGAI. Elektropozityvumas vyksta priešinga elektronegatyvumui. Tai reiškia atomo gebėjimą atsisakyti elektronų.
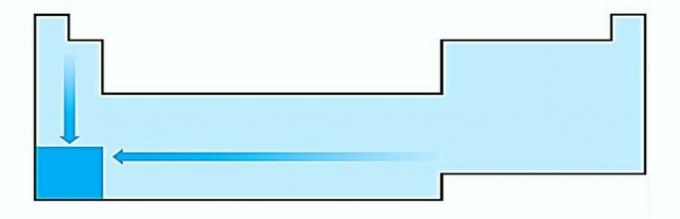
Todėl šarminiai metalai turi didžiausią elektropozityvumą.
Tikrinkite savo žinias pagal sąrašus:
- Cheminių jungčių pratimai
- Elektroninio platinimo pratimai
- Atominių modelių pratimai
- Termochemijos pratimai