* Arrenijaus teorija:
Remdamasis savo elektrinio laidumo vandeninėse terpėse bandymais, cheminiais, fizikiniais ir matematiniais Švedas Svante Augustas Arrheniusas (1859-1927) 1884 m. Pasiūlė šias sąvokas apibrėžti rūgštis ir pagrindai:

Taigi apskritai turime:
H+ + H2O → H3O+
Pavyzdžiai:
HCl + H2O → H3O++ Cl-
HNO3+ H2O → H3O+ + NE3-
H2TIK4+ 2H2O → 2H3O+ + OS42-

Pavyzdžiai:
NaOH → Na + + OH-
Ca (OH)2 → Ca2+ + 2 OH-
* Brönstedo-Lowry teorija:
Nepriklausomai, danas Johannesas Nicolausas Brönstedas (1879–1947) ir anglas Thomasas Martinas Lowry (1874-1936), tais pačiais metais pasiūlė kitą rūgščių ir šarmų teoriją, žinomą kaip Brönstedo-Lowry teorija, kurioje sakoma Stebima:

Šiuo atveju vandenilio jonas laikomas protonu. Tai matyti šioje reakcijoje, kai vandenilio cianido rūgštis vandeniui dovanoja protoną, kuris veikia kaip bazė:
HCN + H2O → CN- + H3O+
Ši reakcija yra grįžtama su hidronio jonu (H3O+) gali paaukoti protoną CN jonui-. Taigi hidronio jonas (H3O+) veikia kaip rūgštis ir CN- kaip bazę.
CN- + H3O+→ HCN + H2O
* Lewiso teorija:
Šią teoriją sukūrė amerikiečių chemikas Gilbertas Newtonas Lewisas (1875–1946) ir sako:

Ši teorija įveda naują koncepciją, yra išsamesnė, tačiau nepaneigia Brönstedo-Lowry teorijos. Kiekviena Lewis rūgštis yra Brönsted rūgštis, todėl kiekviena Lewis bazė yra Brönsted bazė. Taip yra todėl, kad protonas gauna elektronus, o tai reiškia, kad Lewiso rūgštis gali prisijungti prie vienišos elektronų poros Lewiso bazėje.
Lewisui rūgšties ir bazės reakcija susidaro iš stabilesnio koordinuoto kovalentinio ryšio susidarymo. Taigi, kai Lewiso bazė dovanoja elektronų porą Lewiso bazei, jie abu sudaro a koordinatinė kovalentinė jungtis, kurioje abu elektronai yra iš vieno iš atomų, kaip pavyzdyje žemyn:
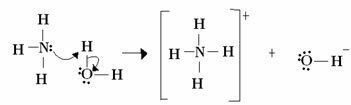
Šiuo atveju amoniakas veikia kaip Lewiso ir Brönstedo bazė, nes jis duoda du savo elektronus protonui ir todėl yra protono imtuvas. Be to, tarp vandenilio (protono) ir amoniako susidarė kovalentinis ryšys.
Vanduo yra Lewiso rūgštis, o Brönstedo rūgštis - dovanodama protoną ir priimdama elektronus, pastebi, kaip iš vandens susidariusiame hidrokside esantis deguonis turi papildomą elektronų porą.

Jennifer Fogaça
Baigė chemiją
Brazilijos mokyklos komanda.
Šaltinis: Brazilijos mokykla - https://brasilescola.uol.com.br/quimica/teorias-acidobase-arrheniusbronstedlowry-lewis.htm
