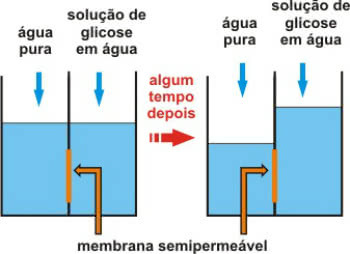
Osmoso slėgis gali būti trumpai apibūdinamas kaip slėgis, būtinas norint išvengti osmoso savaiminio atsiradimo a tai yra tai, kad tirpiklis iš praskiesto tirpalo per membraną pereina į labiau koncentruotą pusiau laidus.
Bet kaip osmoskopija yra bendros nuosavybės, šis faktorius priklauso nuo ištirpusių dalelių kiekio, kuris skiriasi nuo molekulinių ir joninių tirpalų. Todėl osmosinio slėgio (π) apskaičiavimo būdas taip pat skiriasi šiais dviem atvejais.
Molekuliniai tirpalai yra tie, kuriuose ištirpusios medžiagos nejonizuoja vandenyje, tai yra, nesudaro jonų, tačiau jo molekulės paprasčiausiai atsiskiria viena nuo kitos ir ištirpsta tirpale. Tokiais atvejais osmosinį slėgį galima apskaičiuoti pagal šią matematinę išraišką:
π = M. A. T
M = tirpalo moliarumas (mol / L);
R = tobulų dujų visuotinė konstanta, lygi 0,082 atm. L. mol-1. K.-1 arba 62,3 mm Hg L. mol-1. K.-1;
T = absoliuti temperatūra, nurodyta Kelvine.
Šią išraišką pasiūlė mokslininkas Jacobus Henricus Van 't Hoffas Junioras pastebėjęs, kad osmosinio slėgio elgesys labai panašus į tą, kurį rodo idealios dujos. Iš to Van 't Hoffas Júnioras pasiūlė būdą, kaip nustatyti osmosinį slėgį (π) pagal idealią dujų lygtį (PV = nRT).
Pavyzdžiui, sumaišę cukrų su vandeniu, turėsime molekulinį tirpalą, nes cukrus (sacharozė) yra molekulinis junginys, kurio formulė yra C12H22O11. Jo molekulės tiesiog atskiriamos vandeniu, atitrūksta viena nuo kitos, lieka sveikos ir nedalomos.
Ç12H22O11 (s)→Ç12H22O11 (aq)
Esamų molekulių kiekis apskaičiuojamas pagal molių skaičiaus ir Avogadro skaičiaus santykį, kaip parodyta žemiau:
1 molis C12H22O11→s1 molisÇ12H22O11 (aq)
6,0. 1023 molekulės→6,0. 1023 molekulės
Atkreipkite dėmesį, kad ištirpusių molekulių kiekis išlieka toks pat, kaip prieš jas ištirpinant vandenyje.
Taigi, jei atsižvelgsime į 1,0 mol / l sacharozės tirpalą 0 ° C (273 K) temperatūroje, slėgis, kurį reikia daryti, kad būtų išvengta šio tirpalo osmoso, turėtų būti lygus:
π = M. A. T
π = (1,0 mol / L). (0,082 atm. L. mol-1. K.-1). (273 tūkst.)
π ≈ 22,4 atm
Bet jei tirpalas yra joninis, tirpale ištirpusių dalelių kiekis nebus toks pats kaip pradžioje įdėto kiekio, nes susidarys joninis tirpalas arba jo disociacija jonai.
Nesustokite dabar... Po reklamos yra daugiau;)
Pavyzdžiui, įsivaizduokite, kad 1,0 mol HCℓ yra ištirpinta 1 L tirpiklyje, ar mūsų koncentracija bus 1 mol / L, kaip kad nutiko su cukrumi? Ne, nes HCℓ vandenyje vyksta jonizacija taip:
HCℓ → H+(čia) + Cℓ-(čia)
↓ ↓ ↓
1 apgamas 1 mol 1 mol
1 mol / l 2 mol / l
Atkreipkite dėmesį, kad 1,0 mol ištirpusios medžiagos sudarė 2,0 mol ištirpusios medžiagos, o tai turi įtakos tirpalo koncentracijai ir atitinkamai osmosinio slėgio vertei.
Žr. Kitą pavyzdį:
FeBr3 → Fe3+ + 3 br-
↓ ↓ ↓
1 apgamas 1 mol 3 mol
1 mol / l 4 mol / l
Ar matei? Joninių tirpalų koncentracija skiriasi nuo ištirpusio, nes susidarančių jonų kiekis yra skirtingas. Taigi, skaičiuojant joninių tirpalų osmosinį slėgį, reikia atsižvelgti į šį kiekį.
Dėl šios priežasties kiekvienam joniniam tirpalui turite įvesti korekcijos koeficientą, kuris vadinamas Van‘to Hoffo faktorius (jo kūrėjo garbei) ir simbolizuojamas raide „i”. Minėto HCℓ tirpalo Van’t Hoffo faktorius (i) yra 2, o FeBr tirpalo3 é 4.
Matematinė išraiška, naudojama joninių tirpalų osmosiniam slėgiui apskaičiuoti, yra tokia pati kaip ir molekulinių tirpalų plius Van't Hoffo faktorius:
π = M. A. T. i
Žr. Šį skaičiavimą dėl minėtų HC See ir FeBr sprendimų3 esant vienodai 0 ° C temperatūrai, atsižvelgiant į tai, kad abiejų tirpalų koncentracija yra 1,0 mol / l.
HCℓ:
π = M. A. T. i
π = (1,0 mol / L). (0,082 atm. L. mol-1. K.-1). (273 tūkst.). (2)
π ≈ 44,8 atm
FeBr3:
π = M. A. T. i
π = (1,0 mol / L). (0,082 atm. L. mol-1. K.-1). (273 tūkst.). (4)
π ≈ 89,6 atm
Šie skaičiavimai rodo, kad kuo didesnė tirpalo koncentracija, tuo didesnis osmosinis slėgis.Tai yra prasminga, nes osmoso atsiradimo tendencija bus didesnė, taip pat turėsime taikyti didesnį spaudimą, kad galėtume jį sustabdyti.
Jennifer Fogaça
Baigė chemiją
Chemija

Koligatyvinės savybės, tonoskopija, ebulioskopija, krioskopija, osmoskopija, koligatyvinis poveikis, cheminio potencialo sumažėjimas tirpiklio, virimo temperatūra, lydymosi temperatūros kritimas, osmosinis slėgis, nelakios ištirpusios medžiagos, ištirpusios medžiagos, tirpiklis, tempe