Entropija tai sistemos sutrikimo laipsnio matas, matuojantis energijos neprieinamumą.
Tai fizinis dydis, susijęs su Antrasis termodinamikos dėsnis ir kad jis linkęs natūraliai didėti Visatoje.
Entropijos apibrėžimas
„Sutrikimas“ neturėtų būti suprantamas kaip „netvarka“, o veikiau kaip sistemos organizavimo forma.
Entropijos sąvoka kartais taikoma kitose žinių srityse, turint tokį sutrikimo jausmą, kuris yra artimesnis sveikam protui.
Pvz., Įsivaizduokime tris stiklainius: vienas su mažais mėlynais marmurais, kitas - su tokio paties tipo, bet raudonais, o trečias tuščias.
Mes paimame tuščią puodą ir dedame visus mėlynus kamuoliukus po apačia ir visus raudonus kamuoliukus ant viršaus. Šiuo atveju rutuliai yra atskirti ir išdėstyti pagal spalvą.
Purtant puodą, kamuoliukai pradėjo maišytis taip, kad tam tikru momentu nebėra pradinio atsiskyrimo.
Net jei ir toliau purtysime puodą, vargu ar kamuoliai grįš į tą pačią pradinę organizaciją. Tai yra, užsakyta sistema (kamuoliai atskirti spalva) tapo netvarkinga sistema (sumaišyti kamuoliai).

Taigi natūrali tendencija yra didinti sistemos sutrikimą, o tai reiškia entropijos padidėjimą. Tada galime pasakyti, kad sistemose: ΔS> 0, kur S yra entropija.
Taip pat suprask, kas tai yra entalpija.
Entropija ir termodinamika
Entropijos koncepciją pradėjo kurti prancūzų inžinierius ir tyrėjas Nicolasas Sadi Carnotas.
Tyrinėdamas mechaninės energijos transformaciją į šiluminę ir atvirkščiai, jis nustatė, kad neįmanoma turėti visiškai efektyvios šiluminės mašinos.
Pirmasis termodinamikos dėsnis iš esmės lemia, kad „energija yra taupoma“. Tai reiškia, kad fiziniuose procesuose energija neprarandama, ji paverčiama iš vieno tipo į kitą.
Pavyzdžiui, mašina naudoja energiją darbui atlikti ir šiame procese mašina įkaista. Tai yra, mechaninė energija yra skaidoma į šiluminę energiją.
Šiluminė energija nebesikeičia mechaninė energija (jei taip nutiktų, mašina niekada nesutrūktų), todėl procesas yra negrįžtamas.
Vėliau lordas Kelvinas papildė Carnot tyrimus dėl termodinaminių procesų negrįžtamumo ir suteikė pagrindą Antrasis termodinamikos dėsnis.
Rudolfas Clausius pirmasis pavartojo Entropijos terminą 1865 m. Entropija būtų sumos matas Šiluminė energija kurio negalima pakeisti mechanine energija (negalima dirbti) esant tam tikrai temperatūrai.
Clausius sukūrė matematinę entropijos () S variacijos formulę, kuri šiuo metu naudojama.
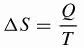
Esamas,
ΔS: entropijos kitimas (J / K)
Klausimas: šilumos perdavimas (J)
T: temperatūra (K)
Skaityk ir tu:
- Termodinamika
- Karno ciklas
- Energija
- Energijos rūšys
- Fizikos formulės
Išspręsti pratimai
1) Priešas - 2016 m
Iki 1824 m. Buvo tikima, kad šiluminiai varikliai, kurių pavyzdžiai yra garo varikliai ir dabartiniai vidaus degimo varikliai, gali veikti idealiai. Sadi Carnot įrodė, kad šiluminės mašinos, veikiančios ciklais tarp dviejų šilumos šaltinių (vieno karšto ir vieno šalto), neįmanoma pasiekti 100% efektyvumo. Toks apribojimas įvyksta todėl, kad šios mašinos
a) atlikti mechaninius darbus.
b) gamina padidėjusią entropiją.
c) naudoti adiabatines transformacijas.
d) prieštarauja energijos taupymo įstatymui.
e) veikti ta pačia temperatūra kaip ir karštas šaltinis.
Alternatyva: b) sukelti padidėjusią entropiją.
2) Priešas - 2011 m
Variklis gali dirbti tik tuo atveju, jei gauna energijos kiekį iš kitos sistemos. Tokiu atveju degaluose sukaupta energija iš dalies išsiskiria degimo metu, kad prietaisas galėtų veikti. Kai variklis veikia, dalis degimo metu paverstos ar transformuotos energijos negali būti naudojama darbui atlikti. Tai reiškia, kad yra energijos nutekėjimas kita forma. Carvalho, A. X. Z.
Terminė fizika. Belo Horizonte: Pax, 2009 (pritaikytas).
Remiantis tekstu, variklio veikimo metu vykstančios energijos transformacijos atsiranda dėl a
a) neįmanoma išleisti šilumos variklio viduje.
b) variklio atliekamas darbas yra nekontroliuojamas.
c) neįmanoma visiškai paversti šilumos į darbą.
d) šilumos energijos pavertimas kinetika yra neįmanomas.
e) galimas kuro energijos suvartojimas yra nekontroliuojamas.
Alternatyva: c) neįmanoma visiškai paversti šilumos į darbą.
Taip pat žiūrėkite: Termodinamikos pratimai



