Kai kurių junginių struktūroje dvigubos jungtys keičiasi su viengubomis jungtimis. Garsiausias iš jų yra benzenas, kurio struktūrą 1865 m. Pasiūlė vokiečių chemikas Friedrichas Augustas Kekulé (1829–1896). Jo struktūra būtų cikliška ir susidarytų iš trijų dvigubų jungčių, įsiterpiančių į tris viengubas jungtis, kaip parodyta toliau pateiktuose paveiksluose:
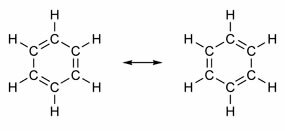
Abu benzolo atvaizdavimo būdai yra priimtini, nes galima pakeisti π jungčių elektronus nekeičiant atomų padėties. Tačiau jis nei tiksliai reprezentuoja tokį, koks jis yra, nei paaiškina jo elgesį. Jis turėtų elgtis kaip alkenas ir sukelti pridėjimo reakcijas, tačiau praktiškai taip nenutinka. Benzenas yra gana stabilus ir veikia taip, lyg jis neturėtų dvigubų ryšių; jis sukelia pakaitų reakcijas kaip alkanuose.
1930 m. Amerikiečių mokslininkas Linusas Paulingas pasiūlė rezonanso teoriją, kuri paaiškino šį akivaizdų prieštaravimą. Ši teorija sakė:
Nesustokite dabar... Po reklamos yra daugiau;)
„Kai tik pagal struktūrinę formulę galime pakeisti elektronų padėtį nekeičiant atomų padėties, tikroji struktūra ne nebus nė viena iš gautų struktūrų, veikiau a rezonanso hibridas tų struktūrų. “
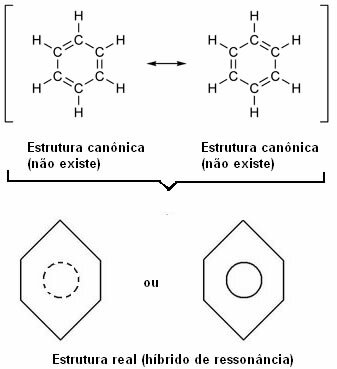
Šį efektą liudija anglies jungčių dydis ir atstumas tarp jų. Šis atstumas yra tarpinis tarp viengubo ryšio (1,54 Å) ir dvigubos jungtys (1,34 Å) atstumo; dėl rezonanso efekto yra 1,39 Å.
Šis efektas taip pat pastebimas ozono molekulės struktūroje (O3), kaip parodyta žemiau:
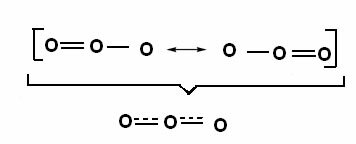
Kanoninės struktūros ir ozono rezonanso hibridai.
Jennifer Fogaça
Baigė chemiją
Brazilijos mokyklos komanda.
Ar norėtumėte paminėti šį tekstą mokykloje ar akademiniame darbe? Pažvelk:
FOGAÇA, Jennifer Rocha Vargas. „Rezonansas cheminiuose junginiuose“; Brazilijos mokykla. Yra: https://brasilescola.uol.com.br/quimica/ressonancia-compostosquimicos.htm. Žiūrėta 2021 m. Birželio 28 d.