Atomai yra be galo mažos dalelės, sudarančios visą materiją visatoje. Laikui bėgant idėja, kokia būtų atominė struktūra, pasikeitė atsižvelgiant į naujus mokslininkų atradimus. Daugiau apie tai galite sužinoti teksteAtominio modelio raida.
Modelis yra tikrovės (o ne pačios realybės) reprezentacija, taigi atominiai modeliai yra reprezentacija pagrindinius atomo komponentus ir jo struktūrą bei paaiškina tam tikrą fizinį ir cheminį materijos elgesį. Tai daroma todėl, kad žmogui dar neįmanoma pamatyti izoliuoto atomo net su ultramikroskopais.
Norėdami sužinoti, koks mažas atomas, žinokite tai The Mažiausia dalelė, matoma įprastu mikroskopu, turi daugiau nei dešimt milijardų atomų! Atomas yra toks mažas, kad, jei padėtume milijoną jų šalia, mes nepasiektume plaukų storis.
Minčių žemėlapis: Atom
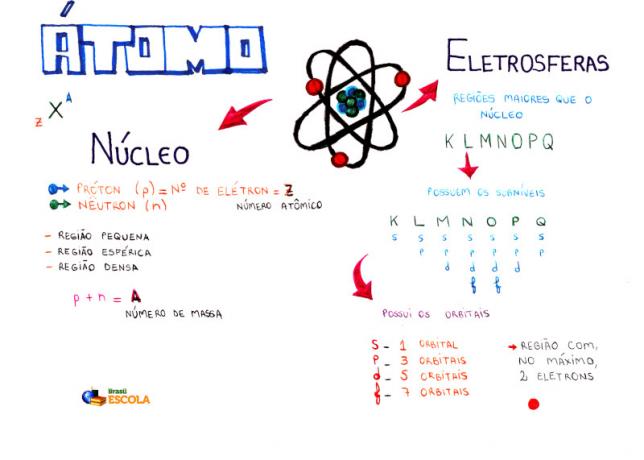
* Norėdami atsisiųsti minčių žemėlapį PDF formatu, Paspauskite čia!
Tarp atominių modelių šiuo metu vidurinėje mokykloje dažniausiai naudojamas atomo struktūrai ir jo savybėms suprasti yra Rutherfordo-Bohro modelis. Pagal šį modelį atomo struktūra susideda iš dviejų pagrindinių dalių:
šerdis ir elektrosfera.
Dvi pagrindinės atomo struktūros dalys - elektrosfera ir branduolys
* Šerdis: Sudaranti centrinę atomo dalį, ji yra kompaktiška, masyvi ir labai tanki, be to, susidaro didesnės masės dalelėmis, kurios yra protonai ir neutronai.

Atominį branduolį sudarančių protonų ir neutronų iliustracija
- protonai: tai dalelės, turinčios teigiamą elektrinį krūvį (santykinis krūvis = +1; krūvis kulonoje (C) = +1,602. 10-19), o jo santykinė masė lygi 1.
Tai, kad protonai sudaro branduolį ir suteikia jam bendrą teigiamą krūvį, atrado Eugenas Goldsteinas, 1886 m., modifikavus Crookes ampulę ir atlikus keletą eksperimentų. Jis matė, kad esant labai aukštai įtampai atsirado išmetamų teršalų (anodo spinduliai - dujų atomų liekanos, esančios lemputės viduje ir kurių elektronus išardė elektros iškrova). Uždėjus elektrinį ar magnetinį lauką už lemputės, šie spinduliai buvo nukreipti link neigiamo poliaus. Tai reiškė, kad yra teigiamų subatominių dalelių, kurios buvo vadinamos protonais.
Vėliau Ernestas Rutherfordas (1871-1937) atliko tekste aprašytą eksperimentą Rutherfordo „Atomas“, kuri paskatino jį atrasti protono vietą: branduolyje.
- Neutronai: tai yra dalelės, kurių masė lygi protonų (1) masei, tačiau, kaip rodo pavadinimas, jos yra neutralios, tai yra, neturi elektrinio krūvio.
Neutronus atrado 1932 m Jamesas Chadwickas (1891-1974), kuris suprato, kad radioaktyviojo berilio branduolys skleidžia neutralias daleles, kurių masė apytiksliai lygi protonų masei (iš tikrųjų ji yra šiek tiek didesnė).
Nesustokite dabar... Po reklamos yra daugiau;)
Branduolio skersmuo priklauso nuo atomo protonų ir neutronų kiekio, tačiau vidutiniškai jis yra apie 10-14 10 mėnuo-15 m.
Atomo branduolys sutelkia praktiškai visą atomo masę ir yra labai maža dalis: tiek protonas, tiek neutronas yra maždaug 100 000 kartų mažesni už patį atomą! Palyginimui įsivaizduokime, kad padidinsime vandenilio elemento atomo branduolį (kuris turi tik protonas) iki teniso kamuoliuko dydžio, arčiausiai elektrono būtų maždaug trys kilometrai atstumas! Net jei atomas būtų padidintas iki 14 aukštų pastato aukščio, jo šerdis būtų vien tik druskos grūdelio dydžio septintame aukšte. Tai tikrai kažkas nuostabaus, nemanai ?!
* Elektrosfera: Yra sritis, kurioje aplink branduolį sukasi elektronai. Nepaisant daug didesnio tūrio nei branduolio srities, jis praktiškai tuščias, nes kiekvienas elektronas yra 1836 kartus mažesnis nei 1 protonas (arba daugiau nei 1 neutronas). Todėl praktiškai visa atomo masė yra branduolyje. Elektronai yra dalelės, turinčios neigiamą elektrinį krūvį (-1).
Elektronus atrado 1897 m Džozefas Johnas Thomsonas (1856-1940), kūrėjas „Thomson“ atominis modelis. Thomsono eksperimentą galima išsamiai pamatyti tekste Thomsono eksperimentas su elektros iškrovomis, bet trumpai tariant, jis panaudojo jau minėtą Crookes ampulę ir suprato, kad katodo spinduliai buvo visada patraukė teigiamas polius, kuris įrodė, kad atomas turėjo neigiamų dalelių, kurios buvo vadinamos elektronai.
Elektronai sukasi aplink branduolį milijardus kartų per milijoninę sekundės dalį, formuodami atomą ir priverčdami jį elgtis taip, lyg jis būtų kietas.
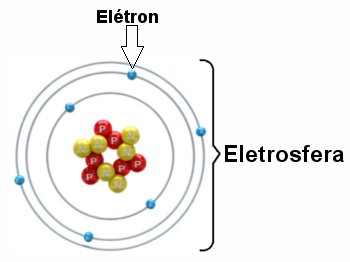
Elektrosferos su trimis elektroniniais sluoksniais ir elektronais, besisukančiais aplink branduolį, iliustracija.
Trumpai tariant, galime sudaryti lentelę, kad išskirtume tris pagrindines subatomines daleles, kurios yra atomo struktūros dalis:

Trijų pagrindinių subatominių dalelių - protonų, neutronų ir elektronų - masė ir elektrinis krūvis
Visų cheminių elementų atomus sudaro šios trys subatominės dalelės. Vieną cheminį elementą nuo kito skiria kiekis, kuriame atsiranda šios dalelės, ypač protonų kiekis branduolyje, kuris vadinamas atominiu skaičiumi. Toliau studijuokite apie tai per tekstą. Cheminis elementas.
* Mano minčių žemėlapis. Diogo Lopes
Jennifer Fogaça
Baigė chemiją
Chemija
Medžiagų, vandens, vandenilio cianido, anglies dioksido, amoniako, vandenilio, helio, medžiagų klasifikavimas paprastos, sudėtinės medžiagos, mišiniai, mišinio fazės, vienalytis mišinys, mišinys nevienalytis.



