At tarpmolekulinės jėgos yra chemijos tema, kuri tikrai gali pasirodyti nacionaliniame vidurinės mokyklos egzamine (Ir arba). Todėl verta patikrinti pagrindinį šio dalyko turinį šiame straipsnyje.
Apibrėžimas
tarpmolekulinės jėgos jos yra įvairaus intensyvumo (silpnos, vidutinės ar stiprios) jėgos - elektrostatinės traukos ar ryšių, užmegztų tarp medžiagos molekulių, palaikančių tarpusavio sąjungą.
Tarpmolekulinių jėgų tipai
) Sukeltas dipolis
Ir tarpmolekulinė jėga kuris atsiranda tarp nepolinės charakteristikos turinčios medžiagos molekulių. Tai atsitinka, pavyzdžiui, tarp medžiagų, tokių kaip O, molekulių2, H2, ne2, CO2, CH4.
Sąjunga tarp šių molekulių atsiranda, kai tarp jų sukuriamas dipolis. Tai atsitinka, kai vienos molekulės elektronai išstumia elektronus iš kitos, taip sukuriant neigiamą ir teigiamą polių, kuris perduodamas iš vienos molekulės į kitą.
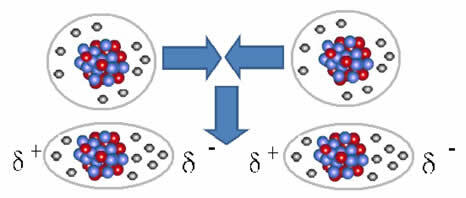
Dipolio susidarymo vaizdavimas nepolinėse molekulėse
Tarp šių molekulių susidarė du poliai, o vienos neigiamas polius sąveikauja su kito teigiamaisiais. Kadangi šie poliai buvo sukurti, tai yra mažo intensyvumo tarpmolekulinė jėga.
B) nuolatinis dipolis
Ir tarpmolekulinė jėga kuris vyksta tarp polinės charakteristikos turinčios medžiagos molekulių. Pavyzdžiai yra medžiagų, tokių kaip HCN, H, molekulės2O, NH3, CO, CH3Cl.
Sąjunga tarp šių molekulių įvyksta, kai vienos neigiamas polius sąveikauja su kitos teigiamais poliais.
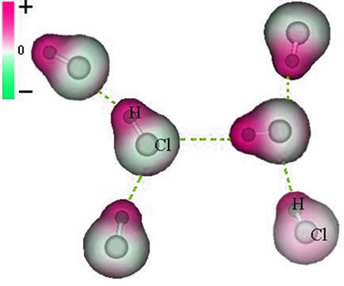
Nuolatinės dipolio jėgos tarp HCl molekulių atvaizdavimas
Kadangi poliai jau egzistuoja, nuolatinė dipolio tarpmolekulinė jėga yra didesnio intensyvumo nei sukelta dipolė.
ç) vandenilio jungtys
Tai tarpmolekulinė jėga jis vyksta tarp polinių molekulių, kurių vandenilio atomas yra tiesiogiai sujungtas su deguonies, azoto ar fluoro atomu.
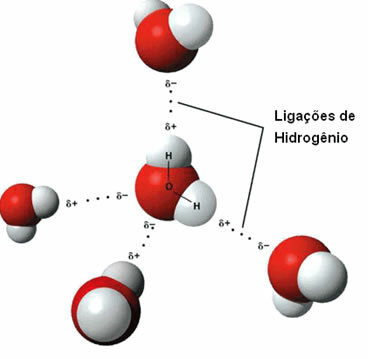
Vandenilio ryšių tarp vandens molekulių atvaizdavimas
Vandenilio ryšys susidaro, kai vandenilis vienoje molekulėje sąveikauja su kitos molekulės deguonimi, azotu ar fluoru.
d) dipolio jonas
Ši tarpmolekulinė jėga atsiranda tarp polinės molekulės, turinčios porą nesusijungiančių elektronų, ir jono (katijono ar anijono) tirpale.
Pavyzdžiui, vandens molekulėje deguonyje yra dvi nepririšančių elektronų poros. Jei vandeninėje terpėje yra jonų, jie priartėja prie vandens molekulės, nes joje yra polių.
Nesustokite dabar... Po reklamos yra daugiau;)
Svarba
Svarba žinoti tarpmolekulinės jėgos Enemui tai supratimas, susijęs su medžiagų fizikinėmis būsenomis, lydymosi temperatūra, virimo temperatūra ir tirpumu.
) Ryšys su medžiagos lydymosi ir virimo temperatūra
Lydymosi temperatūra rodo perėjimo iš kietos į skystą būseną, o virimo temperatūra - perėjimo iš skysčio į dujinę būseną.
Ši ištrauka yra tiesiogiai susijusi su medžiagos molekulių sąveika, nes tai, kas išskiria vieną fizinę būseną nuo kitos, yra jos molekulių agregacijos lygis.
Taigi, kuo intensyvesnė tarpmolekulinė jėga, tuo aukštesnė lydymosi ir virimo temperatūra. Kuo mažiau intensyvi tarpmolekulinė jėga, tuo žemesnė lydymosi ir virimo temperatūra. Taigi mes galime apibrėžti mažėjančią lydymosi ir virimo temperatūros tvarką:
Vandenilio ryšys> nuolatinis dipolis> sukeltas dipolis
B) Santykis su tirpumu
Apskritai turime žinoti, kad panašus ištirpina panašų, tai yra, polinė medžiaga ištirpdo polinę medžiagą, o nepolinė medžiaga - nepolinę.
Tačiau vis dar yra sąveikos tarp ištirpusios medžiagos ir tirpiklio molekulių galimybės. Tai atsitinka tik tuo atveju, jei ši nauja sąveika yra didesnė už tai, kas jau egzistuoja tarp pačios medžiagos molekulių.
Tarpmolekulinės jėgos taikymo Enem pavyzdys
1-as pavyzdys: (Enem-2011) Gerai drėkinama žmogaus oda įgauna gerą elastingumą, švelnią ir glotnią išvaizdą. Kita vertus, kai jis yra sausas, jis praranda elastingumą ir atrodo nepermatomas ir šiurkštus. Norint išvengti odos sausumo, būtina, kai tik įmanoma, naudoti drėkinamuosius drėkinamuosius kremus, paprastai pagamintus iš glicerino ir polietilenglikolio:

Drėkinamųjų medžiagų skatinamas vandens susilaikymas ant odos paviršiaus yra drėkinamųjų medžiagų hidroksilo grupių sąveikos su aplinkoje esančia drėgme pasekmė:
a) joninės jungtys
b) Londono pajėgos
c) kovalentiniai ryšiai
d) dipolio-dipolio jėgos
e) vandenilio jungtys
Atsakymas į šį klausimą yra vandenilio jungimasis, nes vandens molekulė vandenilį sujungia su deguonies atomu. Tas pats atsitinka ir su propilenglikolio ir polietilenglikolio molekulėmis - tai yra palanki sąlyga tokio tipo tarpmolekulinei jėgai atsirasti.
Mano. Diogo Lopes Dias
Ar norėtumėte paminėti šį tekstą mokykloje ar akademiniame darbe? Pažvelk:
DIENOS, Diogo Lopes. „Tarpmolekulinės jėgos priešuose“; Brazilijos mokykla. Yra: https://brasilescola.uol.com.br/quimica/forca-intermoleculares-no-enem.htm. Žiūrėta 2021 m. Birželio 27 d.


