O „Thomson“ atominis modelis 1898 metais pasiūlė anglų fizikas Josephas John Thomsonas arba, paprasčiausiai, J. J. Thomsonas. Po kelių eksperimentiniai elektrono egzistavimo įrodymai, jis panaikino siūlomą atomo nedalomumo teoriją Johnas Daltonas.
Thomsonas, remdamasis savo modeliu, patvirtino ir įrodė elektronai (dalelės, turinčios neigiamą elektrinį krūvį) atome, tai yra, atomas turi subatomines daleles.
Minčių žemėlapis: „Thomson Atomic Model“
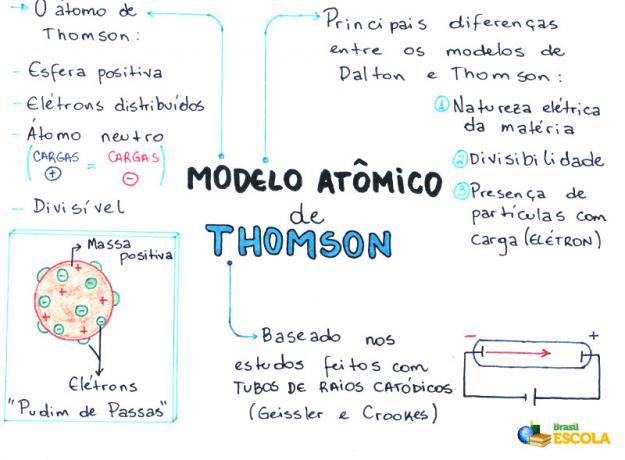
* Norėdami atsisiųsti minčių žemėlapį PDF formatu, Paspauskite čia!
Thomsonas pasiūlė savo atominį modelį remiantis atradimais, susijusiais su radioaktyvumu, ir eksperimentais, atliktais su mokslininkų Geisslerio ir Crookeso pastatytu katodinių spindulių vamzdeliu. Peržiūrėkite šio mėgintuvėlio vaizdą:
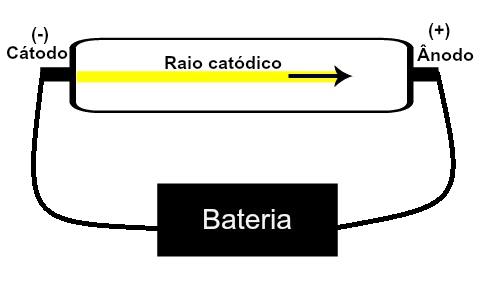
Kai retinamos, žemo slėgio dujos yra veikiamos aukštos elektros įtampos (pvz., 15000 V), jos sukuria a šviesos pluoštas (sudarytas iš elektrinių krūvių) nuo katodo (neigiamo poliaus) link anodo (poliaus) teigiamas).
Atlikdamas šį eksperimentą, Thomsonas padarė išvadą, kad kai viduje yra dujinės medžiagos atomų vamzdžio buvo veikiama aukštos įtampos, jų elektronai buvo išplėšti ir nukreipti į plokštelę teigiamas.
Thomsono atominio modelio pasiūlyti svarstymai
Atlikdamas eksperimentus su katodinių spindulių vamzdeliu, Thomsonas pasiūlė interpretuoti, koks būtų atomas ir jo struktūra. Taigi, anot jo:
- Atomas yra sfera, bet nėra masyvi, kaip siūlo Johno Daltono atominis modelis;
- Atomas yra neutralus, nes visa materija yra neutrali;
- Kadangi atomas turi elektronų, turinčių neigiamą krūvį, todėl jis turi turėti teigiamų dalelių, kad galutinis krūvis būtų nulinis;
- Elektronai nėra fiksuoti ar įstrigę atome, jie tam tikromis sąlygomis gali būti perkelti į kitą atomą;
- Atomą galima laikyti nenutrūkstamu skysčiu su teigiamais krūviais, kur pasiskirstytų neigiamą krūvį turintys elektronai;
- susiejo tavo modeliuoti į razinų pudingą (kurie atstovauja elektronams);
- Kadangi išsibarstę elektronai turi tą patį krūvį, tarp jų yra abipusis atstūmimas, dėl kurio jie tolygiai pasiskirsto rutulyje.
„Thomson“ modelio atomai siūlomos naujovės
Antrasis atomui buvo pasiūlytas Thomsono atominis modelis. Pirmąjį modelį suformulavo Johnas Daltonas.
Nesustokite dabar... Po reklamos yra daugiau;)
Thomsono modelyje buvo nagrinėjamos naujos žinios apie atomą, kurios iki tol nebuvo siūlomos dėl mokslinio pagrindo trūkumo, pavyzdžiui:
- Elektrinė medžiagos prigimtis;
- Atomo dalijimasis;
- Mažų, įkrautų dalelių buvimas atome.
Problemos nurodė Thomsono atomą
Keletas fizikų tuo metu, kai pateikė pasiūlymą „Thomson“ atominis modelis, paremtas klasikinės fizikos teorijomis, atkreipė dėmesį į kai kuriuos šio modelio neatitikimus:
- Thomsonas pasiūlė, kad atomas turėtų stabilumą tolygaus elektronų pasiskirstymo atžvilgiu, kurį gali modifikuoti energijos įtaka. Tačiau klasikinė fizika, paremta elektromagnetizmas, neleidžia egzistuoti stabiliai sistemai, pagrįstai tik atstūmimu tarp to paties krūvio dalelių;
- Thomsonui elektronai tolygiai pasiskirsto atome, tačiau jie turi galimybę paslankiu būdu, todėl tam tikrais dažniais turi skleisti elektromagnetinę spinduliuotę specifinis. Tačiau to nebuvo pastebėta.
- Thomsono modelis dažnai buvo neveiksmingas paaiškinant tokias atomines savybes kaip jų sudėtis ir organizacija.
* Viktoro Ricardo Ferreiros minčių žemėlapis
Chemijos mokytoja
Mano. Diogo Lopes Dias
Ar norėtumėte paminėti šį tekstą mokykloje ar akademiniame darbe? Pažvelk:
DIENOS, Diogo Lopes. „Thomsono atominis modelis“; Brazilijos mokykla. Yra: https://brasilescola.uol.com.br/quimica/o-atomo-thomson.htm. Žiūrėta 2021 m. Birželio 27 d.
Chemija

Nielsas Bohras, Bohro atomas, atominė fizika, stabilus atomas, atomo modelis, planetų sistema, elektrosferos sluoksniai, energijos lygiai, elektronų apvalkalai, elektronų energija, Rutherfordo atominis modelis, sužadinto būsenos atomas.
Chemija
Atomai ir Visatos konstrukcija, atominė teorija, kad viskas yra padaryta, materiją sudaro atomai, keturių elementų teorija, senovės alchemikai, atomų teorija, pagrindinė dalelė.

