Eteris tai yra oksigenuota organinė funkcija, tai yra, be anglies ir vandenilio, jis turi cheminį elementą deguonis. Pagrindinė šios funkcijos struktūrinė charakteristika yra dvi organiniai radikalai prijungtas prie deguonies atomo.
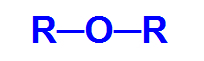
Bendroji eterio struktūrinė formulė
Taigi eterio anglies grandinė yra nevienalytė ir gali turėti du identiškus arba skirtingus radikalus alkilas, radikalų, neturinčių aromatinės struktūros, tipai arba arilo radikalai, neturintys struktūros aromatingas.
Fizinės eterio savybės
Kalbant apie fizinę būseną kambario temperatūroje: kai eteris jo sudėtyje yra keturi ar daugiau anglies atomų, jis yra skystas;
Kalbant apie lydymosi temperatūrą ir virimo temperatūrą: lyginant su kitais masiniais organiniais junginiais apytiksliai molinis, lydymosi temperatūra yra panaši į alkanų ir žemesnė nei kitų junginių ekologiškas;
Kalbant apie tankį: tai junginiai, kurių tankis yra nedidelis, palyginti su vandeniu;
Kalbant apie sąveikos jėgas: eteriai susideda iš mažo poliškumo, sąveikauja tarpusavyje per silpną nuolatinę dipolio sąveiką. Eteriai su vandeniu ir alkoholiais gali sąveikauti per vandenilio jungtis.
Kalbant apie poliškumas: yra junginiai, turintys kampinę geometriją, taigi, jie yra poliniai.
Kalbant apie organoleptinę savybę: tai medžiagos, kurios skleidžia labai malonų kvapą, tačiau jų įkvėpimas gali sukelti priklausomybę.
Oficiali eterio nomenklatūra
Mažojo kamieno priešdėlis + oksis + pagrindinio kamieno priešdėlis + priešdėlis + o
Vykdyti oficialią nomenklatūrą a eteris, Labai svarbu nustatyti, kuris yra jūsų pagrindinis, o kuris - mažasis. Norėdami tai padaryti, vadovaukitės dviem toliau pateiktais šios pavadinimo taisyklės taikymo pavyzdžiais:
1-as pavyzdys:
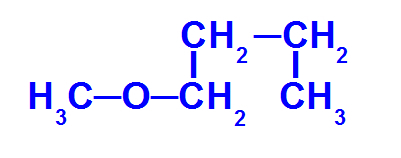
Eterio, turinčio mažiau anglies, struktūrinė formulė
Aukščiau pateiktame eteryje yra šie radikalai:
Metilas (CH3-);
Butilas (CH3-CH2-CH2-CH2-).
Norėdami pavadinti šį junginį, turime:
mažasis radikalus priešdėlis: Met
+
oxy
+
pagrindinio kamieno priešdėlis: bet
+
an (nes jis turi tik pavienes nuorodas)
+
O
Taigi, to pavadinimas eteris tai bus metoksibutanas.
2-as pavyzdys:
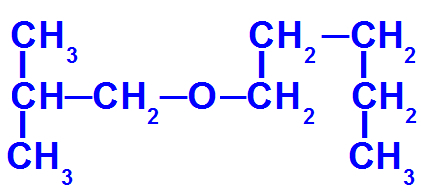
Eterio, turinčio daugiau anglies, struktūrinė formulė
Šis eteris turi šiuos radikalus:
Izobutilas [(CH3)2-CH-CH2-);
pentilas (CH3-CH2-CH2-CH2-CH2).
Taigi, norėdami tai įvardyti, turime:
mažasis radikalus priešdėlis: izobutas
+
oxy
+
pagrindinis kamieno priešdėlis: duobėtas
+
an (nes jis turi tik pavienes nuorodas)
+
O
Taigi, pavadinimas eteris bus izobutoksipentanas.
Įprasta eterio nomenklatūra
Eteris + radikalų pavadinimas (paprasčiausias ir tada sudėtingiausias) + ico
arba
Radikalūs pavadinimai + eteris
Toliau pateikiami du šios pavadinimo taisyklės taikymo pavyzdžiai:
1-as pavyzdys:

Keturių anglių turinčio eterio struktūrinė formulė
Tai eteris pateikia šiuos radikalus:
Metilas (CH3);
Izopropilas (CH3-CH-CH3).
Taigi, šiam junginiui turime:
Eteris
+
mažasis radikalas: metilas
+
pagrindinis radikalus priešdėlis: izopropilas
+
ich
Taigi, pavadinimas eteris nagrinėjamas metilo izopropilo eteris arba metilo izopropilo eteris.
2-as pavyzdys:

Eterio, turinčio penkis anglis, struktūrinė formulė
Aukščiau pateiktame eteryje yra šie radikalai:
Etilas (CH3-CH2-);
Propilas (CH3-CH2-CH2-).
Norėdami pavadinti šį junginį, turime:
Eteris
+
mažasis radikalas: etilas
+
pagrindinis radikalus priešdėlis: propilas
+
ich
Taigi, pavadinimas eteris nagrinėjamas etilo propilo eteris, kuris taip pat gali būti etilo propilo eteris.
Eterių naudojimas
Paprastai eteriai naudojami:
Kaip inertiniai organiniai tirpikliai, tai yra nedalyvauja jokioje reakcijoje;
Naudojamas esencijoms, pavyzdžiui, gėlėms, medienai ir kt., Gauti;
Naudojamas įvairių aliejų ir riebalų ekstrahavimui.
Mano. Diogo Lopes
Šaltinis: Brazilijos mokykla - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-eter.htm


