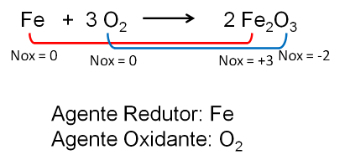
고등학생은 항상 직면 산화 환원 반응 와 이온, 입학 시험과 에넴 (National High School Examination) 모두에서. 따라서 이러한 방정식의 균형을 맞추는 것은 매우 무서운 주제가 될 수 있습니다.
이 주제의 이해를 돕기 위해이 텍스트는 산화 환원 방정식과 이온의 균형 이를 수행하기위한 몇 가지 단계에 대한 설명과 함께. 이를 위해 우리는 이러한 유형의 화학 반응을 식별하는 것으로 시작해야합니다.
에서 이온과의 산화 환원 반응 전하 (양수 또는 음수)가있는 하나 이상의 구성 요소의 존재로 식별됩니다. 이온 (양이온 또는 음이온), 두 예에서와 같이 시약 또는 제품에 존재할 수 있습니다. 따르다:
첫 번째 예:Cr2영형72- + Fe2+ + H+ → Cr3+ + Fe3+ + H2영형
두 번째 예:Cl2 + C + H2O → CO2 + H+ + Cl-
수행하기 위해 산화 환원 반응과 이온의 균형을 맞추고, 다음과 같은 몇 가지 단계를 따라야합니다.
1 단계: NOX 결정 반응물의 각 원자와 방정식의 생성물;
2 단계: 어떤 종이 피해를 입 었는지 확인 산화;
3 단계: NOX 산화를 겪은 종;
4 단계: 3 단계에서 발견 된 변화에 산화 종의 원자 수를 곱합니다.
5 단계: 어떤 종이 피해를 입 었는지 확인 절감;
6 단계: 감소를 겪은 종의 NOX 변이를 결정합니다.
7 단계: 3 단계에서 발견 된 변이에 감소하는 종의 원자 수를 곱합니다.
8 단계: 감소하는 종의 계수로 4 단계에서 찾은 값을 사용합니다.
9 단계: 7 단계에서 찾은 값을 산화 종의 계수로 사용합니다.
10 단계: 방법에 따라 다른 종에 계수를 넣습니다. 시험 균형. 이것이 불가능한 종에서는 미지수를 계수로 넣으십시오.
11 단계: 각 종의 계수에 부하를 곱합니다.
12 단계: 미지 물질을 가진 종 중 하나의 계수를 찾기 위해 반응물의 전하와 생성물의 전하의 합을 동일하게합니다.
13 단계: 시험 방법을 사용하여 잔액을 완성합니다.
이해를 돕기 위해 다음 예제에서 위에서 설명한 단계를 따르십시오. 이온을 사용한 산화 환원 방정식:

일부 이온과 일반 전하 그룹을 보여주는 이온 방정식 0
1 단계 : 각 원자의 NOX.

방정식에 존재하는 원자의 NOX
2 단계 : 산화를 겪는 종.

방정식에서 산화되는 종
요오드의 NOX가 반응물에서 생성물로 -1에서 0으로 증가함에 따라 산화를 겪는 종입니다.
3 단계 : 산화 된 종의 NOX 변화를 결정합니다.
이제 멈추지 마... 광고 후 더 있습니다 ;)
이렇게하려면 가장 낮은 NOX에서 가장 높은 NOX를 빼면됩니다.
∆NOX = (0) – (-1)
∆ NOX = 0 + 1
∆ NOX = 1
4 단계 : 양에 의한 NOX의 곱셈.
이 단계에서는 세 번째 단계에서 발견 된 변이에 종의 원자 수를 곱합니다.
나는- = ∆NOX.1
나는- = 1.1
나는- = 1
5 단계 : 감소를 겪는 종.

방정식의 감소를 겪는 종
크롬 NOX가 반응물에서 생성물로 +7에서 +3으로 감소함에 따라 환원을 겪는 종입니다.
6 단계 : 감소 된 종의 NOX 변화를 결정합니다.
이렇게하려면 가장 낮은 NOX에서 가장 높은 NOX를 빼면됩니다.
∆NOX = (+6) – (+3)
∆ NOX = +6 – 3
∆ NOX = 3
7 단계 : 양에 의한 NOX의 곱셈.
이 단계에서는 여섯 번째 단계에서 발견 된 변이에 종의 원자 수를 곱합니다.
Cr2영형72- = ∆NOX.1
Cr2영형72- = 3.2
Cr2영형72- = 6
8 단계: 균형을 시작하십시오.
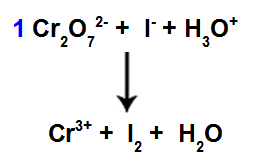
발견 된 계수를 사용하여 균형 조정 시작
이 단계에서는 감소를 겪은 종에 네 번째 단계에서 찾은 계수를 배치하여 균형을 시작합니다.
9 단계: 계속 균형을 유지하십시오.

발견 된 계수를 사용한 균형 유지
10 단계 : 시험 방법을 사용하십시오.
반응물에는 6 개의 I 원자가 있으므로 I 종에 계수 3을 입력해야합니다.2 2 개의 Cl 원자 만 있기 때문입니다.
종 1과 마찬가지로 Cr2영형72-, 2 개의 Cr 원자가 있습니다. Cr 종에 계수 2를 넣어야합니다.3+ 제품의.
우리는 세 종에 산소가 있고 그 중 두 종에는 계수가 없기 때문에 균형을 유지하려면 나머지 종에 미지수를 배치해야합니다.
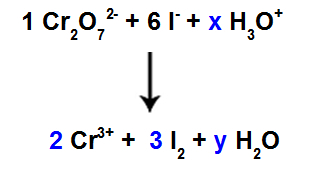
시험 법 사용 후 계수
11 단계 : 부하에 따른 각 종의 곱셈.
이렇게하려면 다음과 같이 종의 계수에 부하를 곱하면됩니다.
시약에서 :
Cr2영형72- = 1.(-2) = -2
나는- = 6.(-1) = -6
H3영형+ = x. (+ 1) = + x
제품에 대해 :
Cr3+ = 2.(+3) = +6
나는2 = 4.0 = 0
H2O = y.0 = 0
12 단계 : 요금 합계.
이 단계에서는 11 단계에서 찾은 시약 및 제품로드를 추가해야합니다.
시약 = 제품
-2 + (-8) + (+ x) = +6 + 0 +0
-2-6 + x = 6
-8 + x = 6
x = 6 + 8
x = 14
13 단계: 균형의 끝.
균형 조정을 완료하려면 다음을 수행해야합니다.
12 단계에서 찾은 결과를 H 종에 넣으십시오.3영형+;
이제 시약에 42 개의 H 원자가 있으므로 H 종에 계수 21을 배치해야합니다.2제품에서.
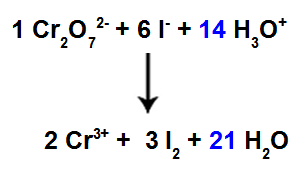
균형 잡힌 이온 반응 방정식
나. Diogo Lopes Dias
이 텍스트를 학교 또는 학업에서 참조 하시겠습니까? 보기:
일, Diogo Lopes. "이온에 의한 적색-환원 반응"; 브라질 학교. 가능: https://brasilescola.uol.com.br/quimica/reacoes-oxirreducao-com-ions.htm. 2021 년 6 월 28 일 액세스.