헤스의 법칙을 사용하면 화학 반응을 거친 후 물질에 존재하는 에너지의 양인 엔탈피 변동을 계산할 수 있습니다. 엔탈피 자체는 측정 할 수 없지만 그 변화는 측정 할 수 없기 때문입니다.
헤스의 법칙은 열화학 연구의 기초가됩니다.
이 법칙은 다음을 확립 한 Germain Henry Hess에 의해 실험적으로 개발되었습니다.
화학 반응의 엔탈피 변화 (ΔH)는 반응 수에 관계없이 반응의 초기 및 최종 상태에만 의존합니다.
헤스의 법칙은 어떻게 계산할 수 있습니까?
엔탈피 변화는 최종 엔탈피 (반응 후)에서 초기 엔탈피 (반응 전)를 빼서 계산할 수 있습니다.
ΔH = H에프 -H나는
이를 계산하는 또 다른 방법은 각 중간 반응의 엔탈피 합계를 사용하는 것입니다. 반응의 수와 유형에 관계없이.
ΔH = ΔH1 + ΔH2
이 계산은 초기 값과 최종 값 만 고려하므로 중간 에너지는 변동 결과에 영향을 미치지 않는다고 결론을 내립니다.
이것은 특별한 경우입니다 에너지 절약의 원리, ㅏ 열역학 제 1 법칙.
또한 헤스의 법칙이 수학 방정식으로 계산 될 수 있음을 알아야합니다. 이를 위해 다음 작업을 수행 할 수 있습니다.
- 화학 반응을 역전시킵니다.이 경우 ΔH 기호도 역전되어야합니다.
- 방정식을 곱하면 ΔH 값도 곱해야합니다.
- 방정식을 나누면 ΔH 값도 나눠 져야합니다.
더 많이 알다 엔탈피.
엔탈피 다이어그램
헤스의 법칙은 에너지 다이어그램을 통해 시각화 할 수도 있습니다.
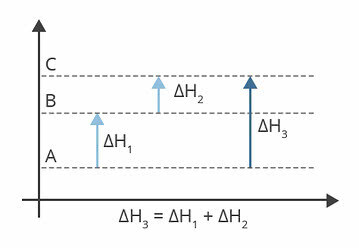
위의 다이어그램은 엔탈피 수준을 보여줍니다. 이 경우 겪는 반응은 흡열 성, 즉 에너지 흡수가 있습니다.
ΔH1 A에서 B로 발생하는 엔탈피 변화입니다. 122 kj라고 가정합니다.
ΔH2 B에서 C로 발생하는 엔탈피 변화입니다. 224kj라고 가정합니다.
ΔH3 A에서 C로 발생하는 엔탈피 변화입니다.
따라서 ΔH의 값을 아는 것이 중요합니다.3, A에서 C 로의 반응 엔탈피 변화에 해당합니다.
ΔH의 값을 찾을 수 있습니다.3, 각 반응의 엔탈피 합계에서 :
ΔH3 = ΔH1 + ΔH2
ΔH3 = 122 kj + 224 kj
ΔH3 = 346 kj
또는 ΔH = H에프 -H나는
ΔH = 346 kj – 122 kj
ΔH = 224 kj
입학 시험: 단계별 해결
1. (Fuvest-SP) 다음 반응과 관련된 엔탈피 변이를 기반으로합니다.
엔2 (g) + 2O2 (g) → 2 아니오2 (g) ∆H1 = +67.6 kJ
엔2 (g) + 2O2 (g) → N2영형4 (g) ∆H2 = +9.6 kJ
NO 이량 체화 반응과 관련된 엔탈피 변화를 예측할 수 있습니다.2 다음과 같습니다.
2NO2 (g) → 1N2영형4 (g)
a) -58.0 kJ b) +58.0 kJ c) -77.2 kJ d) +77.2 kJ e) +648 kJ
해결:
1 단계: 첫 번째 방정식을 반전합니다. 아니요2 (g) 글로벌 방정식에 따라 반응물쪽으로 이동해야합니다. 반응을 역전시킬 때 ∆H1도 부호를 역전시켜 음수로 바꿉니다.
두 번째 방정식은 보존됩니다.
2 아니오2 (g) → N2 (g) + 2O2 (g) ∆H1 = - 67.6 kJ
엔2 (g) + 2O2 (g) → N2영형4 (g) ∆H2 = +9.6 kJ
2 단계: N2 (g) 제품과 시약에 나타나며 2 mol의 O에서도 마찬가지입니다.2 (g).
2 아니오2 (g) → 엔2 (g)+ 2 O2 (g)∆H1 = - 67.6 kJ
엔2 (g) + 2 O2 (g) → N2영형4 (g) ∆H2 = +9.6 kJ
따라서 취소하면 다음 방정식이 생성됩니다.
2 아니오2 (g) → N2영형4 (g).
3 단계: 글로벌 방정식에 도달했음을 알 수 있습니다. 이제 방정식을 추가해야합니다.
∆H = ∆H1 + ∆H2
∆H =-67.6 kJ + 9.6 kJ
∆H = -58kJ ⇒ 대안 A
∆H의 음수 값으로부터 우리는 또한 그것이 열 방출과 함께 발열 반응이라는 것을 압니다.
자세한 내용은 다음을 참조하십시오.
- 열화학
- 열화학 연습
- 흡열 및 발열 반응
- 열역학 제 2 법칙
수업 과정
1. (UDESC-2012) 방정식 1과 같이 메탄 가스를 연료로 사용할 수 있습니다.
CH4 (g) + 2O2 (g) → CO2 (g) + 2H2영형(지)
필요하다고 생각하는 아래의 열화학 방정식과 헤스의 법칙 개념을 사용하여 방정식 1의 엔탈피 값을 구하십시오.
씨(에스) + H2영형(지) → CO(지) + H2 (g) ΔH = 131.3 kJ mol-1
CO(지) + ½2 (g) → CO2 (g) ΔH = – 283.0 kJ mol-1
H2 (g) + ½2 (g) → H2영형(지) ΔH = – 241.8 kJ mol-1
씨(에스) + 2H2 (g) → CH4 (g) ΔH = – 74.8 kJ mol-1
방정식 1의 엔탈피 값 (kJ)은 다음과 같습니다.
a)-704.6
b)-725.4
c)-802.3
d)-524.8
e)-110.5
c) – 802.3
2. (UNEMAT-2009) 헤스의 법칙은 열화학 연구에서 근본적으로 중요하며 다음과 같이 말할 수 있습니다. “화학 반응에서 엔탈피의 변화는 화학 반응의 초기 및 최종 상태에만 의존합니다. 반응". 헤스 법칙의 결과 중 하나는 열화학 방정식을 대수적으로 처리 할 수 있다는 것입니다.
방정식이 주어지면 :
씨 (석묵) + O2 (g) → CO2 (g) ΔH1 = -393.3 kj
씨 (다이아몬드) + O2 (g) → CO2 (g) ΔH2 = -395.2 kj
위의 정보를 바탕으로 흑연 탄소에서 다이아몬드 탄소로의 엔탈피 변화를 계산하고 올바른 대안을 선택하십시오.
a) -788.5 kj
b) +1.9 kj
c) +788.5 kj
d) -1.9 kj
e) +98.1 kj
b) +1.9 kj



