수화 된 소금 이것은 소금 여기에서 화합물의 이온은 물 분자를 결정 격자에 통합하여 이러한 분자를 염 결정의 일부로 만듭니다.
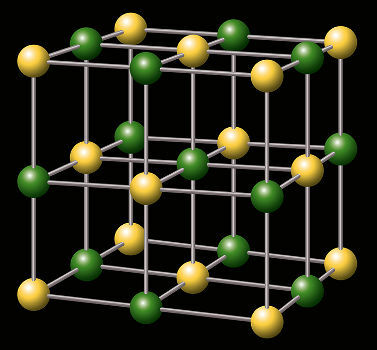
소금의 결정 격자 표현
A의 화학 공식 수화 된 소금 양이온 (X)이 존재하는 패턴을 따릅니다.+), 음이온 (Y-) 및 다음 모델에서 볼 수있는 바와 같이 물의 몰에서 일정량 (n) :
XY.nH2영형
형성하려면 의 명명법 수화 된 소금, 우리는 다음 규칙을 수행해야합니다.
음이온 이름 + de + 양이온 이름 + 접두사 + 수화
참고: 명명 규칙에 표시된 접두사는 소금 공식에 존재하는 물의 몰 양을 나타내므로 1 몰 (모노), 2 몰 (d), 3 몰 (트리) 등이 있습니다.
첫 번째 예 : FeCl2.2.H2영형
이 수화 된 소금에는 다음과 같은 성분이 있습니다.
철 양이온 II (Fe+2);
염화 음이온 (Cl-);
H 2 몰2O (접두사 di).
그래서 그 이름은 염화철 II 이수화 물이 될 것입니다.
두 번째 예: MgSO44.7.H2영형
이 수화 된 소금에는 다음과 같은 성분이 있습니다.
마그네슘 양이온 (Mg+2);
황산 음이온 (SO4-2);
H 7 몰2O (접두사 hepta).
그래서 그 이름은 황산 마그네슘 7 수화물이 될 것입니다.
세 번째 예 : ZnBr2.8.H2영형
이 수화 된 소금에는 다음과 같은 성분이 있습니다.
아연 양이온 (Zn+2);
브로마이드 음이온 (Br-1);
8 mol의 H2O (접두사 옥타).
그래서 그 이름은 아연 브로마이드 8 수화물이 될 것입니다.
화학적 변형
수화 된 염이 가열 과정을 거치면 결정 구조에 포함 된 물 분자가 증기 형태로 방출되어 단순한 염만 남습니다.
나. Diogo Lopes
출처: 브라질 학교- https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-sal-hidratado.htm