에서 일반 배터리 불린다 Leclanché 배터리 발명가 인 프랑스 화학자 George Leclanché (1839-1882)의 이름을 따서 명명되었습니다.

조지 르클 랑체 (1839-1882)
Leclanché는 1866 년에 이러한 유형의 배터리를 만들었습니다. 그녀는 또한 건전지 그 전까지는 다음과 같은 수용액을 사용하는 배터리 만있었습니다. 다니엘의 더미.
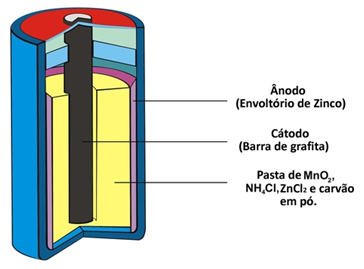
이 유형의 파일이 구성으로 인해받는 다른 두 가지 이름은 산성 더미 또는 아연 탄소 배터리. 기본적으로 다공성 종이를 사용하여 파일을 구성하는 다른 화학 종과 분리 된 아연 외피로 형성됩니다.
이 아연은 아래의 반 반응에 따라 산화되어 두 개의 전자를 잃는 셀 또는 양극의 음극에 해당합니다.
음극-양극: Zn (에스) → Zn2+(여기) + 2 및-
이 파일은 또한 양극 인 음극을 가지고 있는데, 이는 이산화망간 (MnO)으로 둘러싸인 파일의 중앙에 설치된 흑연 막대입니다.2), 분말 목탄 (C) 및 염화 암모늄 (NH4Cl), 염화 아연 (ZnCl2) 및 물 (H2영형).
염화 암모늄과 염화 아연은 산성 특성을 가진 염이므로 "산성 세포"라는 이름이 붙습니다.
흑연 막대는 아연에 의해 손실 된 전자를 망간으로 전도하여 이산화망간 (MnO)을 감소시킵니다.2) 삼산화 망간 (Mn2영형3), 다음 반 반응에 따라 :
양극-음극: 2 MnO2 (수성) + 2 NH41+(여기) + 2e- → 1 백만2영형3(에스) + 2NH3 (g) + 1 시간2영형(1)
습식 페이스트는 염점 역할을하여 하이드 록실 음이온 (OH-) 흑연에서 아연으로.
전반적인 반응은 다음과 같습니다.
Zn (에스) + 2 MnO2 (수성) + 2 NH41+(여기) → Zn2+(여기) + 1 백만2영형3(에스) + 2NH3 (g)
따라서이 배터리는 모든 이산화망간이 삼산화 망간으로 변환되기 때문에 재충전 할 수 없습니다. 배터리 작동이 중지되면 폐기해야합니다.
이 배터리의 ddp는 1.5V입니다. 그러나 암모니아 (NH3 (g)) 음극에 형성된 흑연은 흑연 막대에 증착되어 전자의 통과를 방해하고 배터리의 전압을 낮출 수 있습니다. 정상 작동으로 돌아가려면 배터리를 아연 양이온 (Zn
2+(여기)) 양극에서 형성된 암모니아와 반응하여 흑연 막대를 자유롭게합니다.또한 온도를 낮추면 파일의 축축한 페이스트에서 암모니아의 용해도가 높아지기 때문에 파일을 냉장고에 넣는 것도 도움이 될 수 있습니다.
Leclanché 건전지에 대해 고려해야 할 또 다른 중요한 요소는 아연 케이스가 부식되어 부식성 물질이 누출되어 장치가 손상 될 수 있습니다.. 따라서 가장 좋은 방법은 배터리를 계속 사용하지 않는 장치 내부에 두지 않는 것입니다.
건전지는 리모콘, 벽시계, 휴대용 라디오 및 장난감과 같이 가볍고 지속적인 방전이 필요한 장비에 표시됩니다.
작성자: Jennifer Fogaça
화학 전공
출처: 브라질 학교- https://brasilescola.uol.com.br/quimica/pilha-seca-leclanche.htm


