텍스트 "비대칭 탄소와 광학 이성체를 가진 분자"분자에 비대칭 또는 키랄 탄소가 하나만있을 때 (모든 리간드가 서로 다름), 두 개의 광학 활성 이성질체와 하나의 광학 비활성 이성질체 (혼합물 라세 믹).
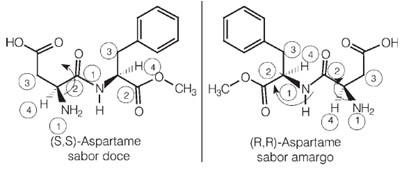
이제 두 개 이상의 다른 비대칭 탄소가있는 경우를 생각해 봅시다. 즉, 리간드 중 적어도 하나가 동일하지 않기 때문에 서로 다른 것으로 간주됩니다. 예를 들어, 자당 (설탕)보다 180 배 더 달기 때문에 인공 감미료에 사용되는 아스파탐의 공식을 생각해보십시오.
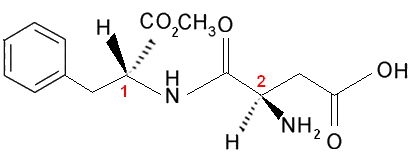
이 분자에는 두 개의 키랄 탄소가 있으며 이미지에서 숫자로 식별됩니다. 1 과 2. 이 탄소는 서로 다른 4 개의 결합 그룹을 가지고 있으므로 비대칭으로 간주됩니다. 탄소 리간드를 비교할 때 1 탄소로 2, 우리는 유일한 반복 리간드가 H (수소)이므로 다른 비대칭 탄소임을 알 수 있습니다.
이 분자와 두 개의 비대칭 탄소를 가진 모든 분자는 항상 다음을 갖습니다. 4 개의 광학 활성 이성질체 및 2 개의 광학 비활성 이성질체 (2 개의 라 세미 혼합물).
가능한 확률은 다음과 같기 때문에 이것을 알고 있습니다.

다른 쌍의 이성질체는 오른 손잡이 탄소 -1과 오른 손잡이 탄소 -2의 혼합물과 같은 부분 입체 이성질체 (서로 거울상이 아님)입니다.
그러나 많은 분자가 3, 4, 5 또는 그 이상의 비대칭 탄소를 가지고 있기 때문에 각 분자에 대한 모든 가능성을 계속 조사해야한다면 매우 어려울 것입니다.
따라서 분자의 광학 활성 및 비활성 이성질체 양을 결정하는 가장 쉬운 방법은 다른 비대칭 탄소는 Van’t Hoff와 Le가 제안한 아래의 수학 식을 통해서입니다. 벨 :
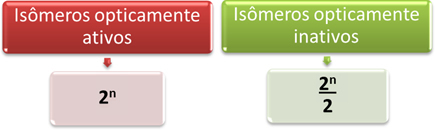
여기서 "n"은 분자 내 다른 비대칭 탄소의 양입니다. 예를 들어, 아스파탐의 경우 두 개의 비대칭 탄소이므로 다음과 같습니다.
- 광학 활성 이성질체: 2아니 = 22 = 4;
- 광학적으로 비활성 이성질체: 2아니 = 22 = 2.
2 2
이전에 언급 한 금액과 정확히 일치했습니다.
흥미롭게도 아스파탐의 거울상 이성질체 중 하나는 인공 감미료에 사용되는 단맛이 있지만 광학 이성질체 중 하나는 쓴 맛이 있습니다.
이제 또 다른 예인 과당 분자를 살펴보십시오.
OH O H OH OH OH
│ ║ │ │ │ │
H C ─ C ─ 씨 ─ 씨 ─ 씨 ─ C ─ H
│ │ │ │ │
H OH H H H
과당은 3 개의 비대칭 탄소 원자를 가지고 있습니다. 우리는 8 개의 광학적으로 활성이있는 이성질체와 4 개의 광학적으로 비활성 인 이성질체를 가지고 있는데, 이것은 4 개의 라 세미 혼합물입니다.
- 광학 활성 이성질체: 2아니 = 23 = 8;
- 광학적으로 비활성 이성질체: 2아니 = 23 = 4.
2 2
작성자: Jennifer Fogaça
화학 전공
출처: 브라질 학교- https://brasilescola.uol.com.br/quimica/isomeros-moleculas-com-carbonos-assimetricos-diferentes.htm