Kp 결정하는 데 사용되는 약어입니다. 평형의 상수 부분 압력 측면에서. 이 상수는 예를 들어 atm 단위에서 평형의 기체 참가자의 값과 함께 작동합니다.

기체 성분과의 화학 반응을 나타내는 방정식
이 방정식에서 모든 참가자는 기체이므로 참가 기체가 혼합물의 분압, 약어 pX로 표시됩니다.
화학 평형 방정식(농도 측면에서)을 설정할 때, 생성물은 분자에 배치되어야 하고 반응물은 분모에 배치되어야 합니다.
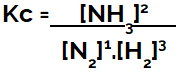
암모니아 형성 평형의 Kc 표현
의 표현 압력에 대한 평형 상수(Kp) 의 패턴을 따른다 KC즉, 시약의 분압은 분모에 위치하고 제품의 부분 압력은 분자에 위치합니다.
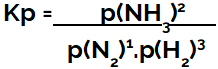
암모니아 형성 평형의 Kp 발현
관찰: 의 반응식이라면 화학적 균형 기체 참가자를 표시하지 마십시오. 자동으로 표시되지 않습니다. Kp.
예: (PUC-MG) 반응: 2 CO(NS) + 오2(g)? 2 CO2(g), CO 분압(NS) 그건2(g) 평형에서 그것들은 각각 0.2atm과 0.4atm이다. 총 시스템 압력은 1.4 atm입니다. 의 가치 Kp 반응은 다음과 같습니다.
가) 56.2
나) 40.0
다) 35.6
라) 28.4
마) 25.6
실습에서 제공하는 데이터는 다음과 같습니다.
일산화탄소 부분압(pCO) = 0.2 atm;
일산화탄소의 분압(pO2) = 0.4 기압;
총 압력 = 1.4 기압;
이 시스템의 Kp를 결정하려면 다음 단계를 수행해야 합니다.
1단계: 일산화탄소(pCO)의 분압을 결정합니다.2).
이를 위해 총 압력(pt)은 모든 부분 압력의 합이라는 것을 기억하십시오.
pt = pCO + pCO2 + PO2
1.4 = 0.2 + p(CO2) + 0,4
1.4 - 0.2 - 0.4 = pCO2
PCO2 = 0.8 기압
2단계: 운동의 Kp를 결정하십시오.
이를 위해 평형 상수 Kp의 표현에서 값을 사용하십시오.
Kp = (pCO2)2
(pCO)2.(먼지2)1
Kp = (0,8)2
(0,2)2.(0,4)1
Kp = 0,64
0,04.0,4
Kp = 0,64
0,016
Kp = 40 기압-1
By Me 디오고 로페스 디아스
원천: 브라질 학교 - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-kp.htm
