열화학은 화학 반응에 관련된 열 (에너지)의 양을 연구하는 화학의 일부입니다.
반응이 열을 방출하면 발열 성으로 분류됩니다. 반응에서 열을 흡수하면 흡열이 발생합니다.
열화학은 또한 물질 상태의 변화와 같은 일부 물리적 현상에서 에너지 전달을 연구합니다.
열화학 및 열
화학 반응에서 에너지는 흡수되거나 방출 될 수 있습니다. 이 열전달은 가장 높은 온도를 가진 신체에서 가장 낮은 온도를 가진 신체로 전달됩니다.
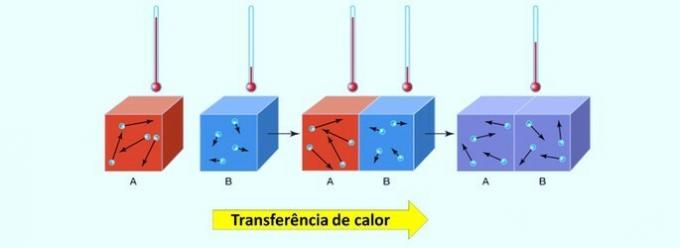
열 에너지라고도 불리는 열은 두 물체 사이의 열 에너지 교환을 결정하는 개념이라는 것을 기억할 가치가 있습니다. 영형 열 균형 두 재료가 동일한 온도에 도달하면 설정됩니다.
흡열 및 발열 반응
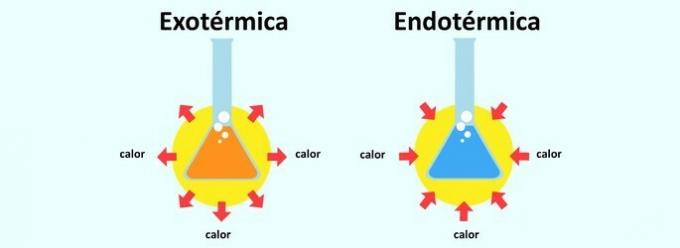
그것은 ~라고 불린다 흡열 반응 열이 흡수되는 반응. 이런 식으로 신체는 삽입 된 환경에서 열을 흡수합니다. 그렇기 때문에 흡열 반응이 시원함을 유발합니다.
예: 팔에 알코올을 문지르면 팔이이 물질의 열을 흡수합니다. 그러나 술을 마신 후 팔을 부면 흡열 반응의 결과 인 약간의 냉기가 느껴집니다.
이미 발열 반응 그 반대입니다. 그것은 열의 방출이므로 느낌이 따뜻해집니다.
예: 캠프에서는 사람들이 불 옆에 서서 화염에 의해 방출되는 열이 주변 사람들을 따뜻하게합니다.
열 교환은 또한 몸 상태. 고체에서 액체로, 액체에서 기체로의 변화에서 그 과정은 흡열 성이라는 것이 밝혀졌습니다. 반대로 기체에서 액체로, 액체에서 고체로의 변화는 발열입니다.
엔탈피
엔탈피 (H)는 에너지 에너지 흡수 및 방출 반응에서 각각 흡열 및 발열로 교환됩니다.
엔탈피를 측정 할 수있는 장치는 없습니다. 이러한 이유로 반응물의 엔탈피 (초기 에너지)와 생성물의 엔탈피 (최종 에너지)를 고려하여 변동 (ΔH)을 측정합니다.
가장 자주 발생하는 엔탈피 유형은 다음과 같습니다.
| 형성 엔탈피 | 물질 1 몰을 형성하는 데 필요한 흡수 또는 방출 에너지. |
|---|---|
| 연소 엔탈피 | 물질 1 몰을 태우는 방출 된 에너지. |
| 링크 엔탈피 | 기체 상태에서 1 몰의 화학 결합이 끊어 질 때 흡수 된 에너지. |
엔탈피는 에너지를 측정하지만 엔트로피 화학 반응의 장애 정도를 측정합니다.
헤스의 법칙
Germain Henry Hess는 다음과 같이 설정했습니다.
화학 반응의 엔탈피 변화 (ΔH)는 반응 수에 관계없이 반응의 초기 및 최종 상태에만 의존합니다.
헤스의 법칙에 따라 에너지의 변화는 다음 공식을 통해 설정됩니다.
ΔH = H에프 -H나는
어디,
- ΔH: 엔탈피 변이
- H에프: 최종 엔탈피 또는 제품 엔탈피
- H나는: 초기 엔탈피 또는 시약 엔탈피
이것으로부터 우리는 발열 반응에 직면했을 때 엔탈피 변이가 부정적이라는 결론을 내립니다. 차례로, 우리가 흡열 반응에 직면했을 때 엔탈피 변이는 긍정적입니다.
주제에 대해 더 자세히 알아 보려면이 텍스트를 확인하십시오.:
- 열역학
- 열량 측정
- 현열
- 잠열
의견이 달린 연습 문제
1. (Udesc / 2011) 다음 방정식이 주어집니다.
| (그만큼) | 2CO(지) + O2 (g) → 2CO2(지) | ΔH =-565.6 kj |
| (비) | 2 채널4영형(지) +302 (g) → 2CO2(지) + 4 시간2영형(1) | ΔH =-1462.6 kj |
| (씨) | 3O2 (g) → 2O3 (g) | ΔH = + 426.9 kj |
| (디) | 신앙2영형3 (g) + 3C(에스) → 2Fe(에스) + 3CO(지) | ΔH = +490.8 kj |
방정식과 관련하여 다음 제안을 고려하십시오.
나는. 반응 (A) 및 (B)는 흡열입니다.
II. 반응 (A) 및 (B)는 발열입니다.
III. 반응 (C) 및 (D)는 발열입니다.
IV. 반응 (C) 및 (D)는 흡열입니다.
V. 에너지가 가장 많이 방출되는 반응은 (B)입니다.
보았다. 에너지 방출이 가장 큰 반응은 (D)입니다.
올바른 대안을 확인하십시오.
a) 진술 II, III 및 V 만 참입니다.
b) 진술 I, III 및 VI 만 참입니다.
c) 진술 I, IV 및 VI 만 참입니다.
d) 진술 II, V 및 VI 만 참입니다.
e) 진술 II, IV 및 V 만 참입니다.
올바른 대안: e) 문 II, IV 및 V 만 참입니다.
a) 잘못되었습니다. 진술 III는 사실이 아닙니다.
문 III와 달리 반응 (C) 및 (D)는 흡열 성이며, 엔탈피 변동의 양수 기호는 열 흡수를 나타냅니다.
b) 잘못되었습니다. 이 대안에 인용 된 어떤 진술도 정확하지 않습니다. 다음과 같은 이유로 잘못되었습니다.
- 반응 (A) 및 (B)는 발열 성이며, 엔탈피 변화의 음수 기호는 열 방출을 나타냅니다.
- 반응 (C) 및 (D)는 엔탈피 변화의 양수 기호가 열 흡수를 나타 내기 때문에 흡열입니다.
- 반응 (D)은 흡열 성이므로 에너지를 방출하지 않습니다.
c) 잘못되었습니다. 이 대안에 인용 된 세 가지 진술 중 IV 만 정확합니다. 다른 두 가지는 다음과 같은 이유로 잘못되었습니다.
- 반응 (A) 및 (B)는 발열 성이며, 엔탈피 변화의 음수 기호는 열 방출을 나타냅니다.
- 반응 (D)은 에너지를 방출하지 않으며, 엔탈피 변화의 양수 부호는 반응이 흡열임을 나타냅니다.
d) 잘못되었습니다. 진술 VI는 사실이 아닙니다.
문 VI와 달리 반응 (D)은 흡열 성이므로 에너지를 방출하지 않습니다.
a) 정답. 다음과 같은 이유로 진술이 정확합니다
- 반응 (A) 및 (B)는 에너지 변화가 음이므로 발열 성입니다.
- ΔH 값이 양수이므로 반응 (C) 및 (D)는 흡열 성입니다.
- 가장 큰 에너지 방출을 가진 반응은 (B)입니다. 발화의 발열 반응 중 음수 부호가있는 가장 높은 값을 가진 반응이기 때문입니다.
이 텍스트는 지식을 늘리는 데 도움이 될 것입니다:
- 열화학 연습
- 화학적 변형
- 화학 반응
2. (Enem / 2011) 콩을 요리 할 때 특이한 옵션은 보온병을 사용하는 것입니다. 팬에 콩과 물 세 부분을 넣고 5 분 정도 끓인 다음 모든 재료를 보온병에 옮깁니다. 약 8 시간 후에 콩이 조리됩니다.
콩 요리는 보온병 안에서 이루어집니다.
a) 물은 콩과 반응하며이 반응은 발열입니다.
b) 콩은 흡열 과정이므로 주변 물에서 열을 계속 흡수합니다.
c) 고려 된 시스템이 실질적으로 격리되어 콩이 에너지를 얻거나 잃지 않도록합니다.
d) 보온병은 반응이 시작되면 콩을 요리하기에 충분한 에너지를 제공합니다.
e) 반응에 관여하는 에너지는 물을 가열하여 발열 과정이므로 일정한 온도를 유지합니다.
올바른 대안: b) 콩은 흡열 과정이기 때문에 주변 물에서 열을 계속 흡수합니다.
a) 잘못되었습니다. 화학 반응은 콩을 요리 할 때 발생하지 않는 새로운 물질의 형성을 특징으로합니다.
b) 정답. 물이 가열되면 열이 발생하고 보온병은이 에너지가 환경으로 손실되는 것을 허용하지 않습니다. 따라서 콩은 물에서 열을 흡수하고 흡열 과정을 통해 조리됩니다.
c) 잘못되었습니다. 시스템은 외부 환경과 격리되어 있습니다. 병 내부에서 콩과 물은 직접 접촉하여 열 교환을 수행합니다.
d) 잘못되었습니다. 보온병은 시스템 내부의 혼합물이 환경과 열을 교환하지 못하도록 시스템을 단열하는 기능이 있습니다.
e) 잘못됨. 물이 원두에 열을 전달하기 때문에 온도는 일정하지 않으며 두 온도가 같을 때까지 에너지를 잃습니다.
아래 텍스트를 확인하고 이번 호에서 다루는 주제에 대해 자세히 알아보십시오.:
- 물리적 및 화학적 변형
- 열과 온도
- 열 에너지