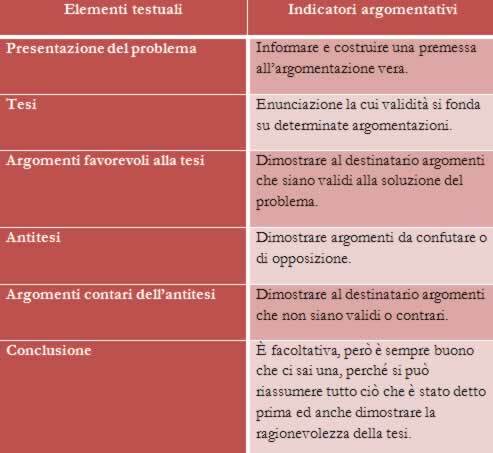
자신을 다음과 같이 정의합니다. 이종 교잡 불완전한 원자 궤도의 결합. 궤도는 하나만있는 경우 불완전한 것으로 분류됩니다. 전자 두 개 대신 안에. 불완전한 궤도와 완전한 궤도의 표현을보십시오 :

이미지 A에는 완전한 궤도가 있습니다. 이미지 B에서는 불완전한 궤도입니다.
혼성화는 인, 유황, 탄소 등과 같은 일부 화학 원소에서 발생하는 자연 현상입니다. 탄소의 혼성화 이 원소의 원자가 4 개의 화학 결합을 만들 수 있도록합니다. 즉, 탄소는 혼성화 현상을 겪은 후에 만 4 개의 결합을 만듭니다.
그러나 탄소는 왜 하이브리드 화하고 4 개의 결합을 만들까요? 이 현상을 이해하려면이 요소의 전자 분포를 알아야합니다.
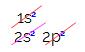
탄소의 전자 분포에서 우리는 1s 하위 수준이 완료되었음을 알 수 있습니다 (2 개의 전자 포함), 2s는 완전 (2 개의 전자 포함)이고 2p 하위 수준은 불완전합니다 (p 하위 수준은 6 개의 전자를 지원하지만 두). 2p 전자를 대표적인 방식으로 분배하려면 다음을 수행해야합니다.
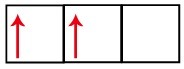
p 하위 수준에는 세 개의 궤도가 있습니다. 탄소의 경우 두 개는 불완전하고 하나는 비어 있습니다. 이러한 이유로이 요소는 불완전한 궤도의 수가 항상 링크 수를 결정하므로 두 개의 링크 만 수행해야합니다.
그러나 외부 환경에서 에너지를 받으면 탄소에 존재하는 전자가 여기됩니다. 따라서 하위 수준 2에 존재하는 전자 중 하나가 비어있는 하위 수준 p의 궤도로 이동합니다.
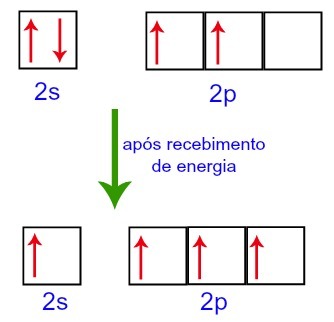
외부 환경으로부터 에너지를 받기 전후의 탄소 궤도
따라서 탄소는 두 번째 수준에서 4 개의 불완전한 궤도를 남깁니다. 그런 다음 2s 하위 수준의 궤도가 3 개의 p 궤도를 결합하여 다음 현상을 구성합니다. 이종 교잡.
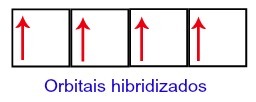
혼성화 후 탄소 궤도
나로. Diogo Lopes Dias
출처: 브라질 학교- https://brasilescola.uol.com.br/quimica/hibridizacao-carbono.htm