그만큼 엔탈피 (H) 각 재료의 에너지 함량 또는 시스템의 전체 에너지로 정의 할 수 있습니다. 그러나 실제로 물질의 엔탈피를 결정하는 것은 불가능합니다. 따라서 일반적으로 측정되는 것은 엔탈피 변이 

여기서 우리는 발열 반응에서 엔탈피의 변이를 분석 할 것입니다 ( "exo"라는 단어는 그리스어에서 유래하고 "out, out, out"을 의미 함). 열 방출이있는 반응입니다. 일상 생활에는 연소 및 생석회와 물의 혼합물과 같은 이러한 반응의 많은 예가 있습니다.
이 경우 엔탈피 변이 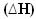 최종 엔탈피에서 초기 엔탈피를 뺀 값 (H에프 -H나는) 또는 반응이므로 생성물의 엔탈피 값에서 반응물의 엔탈피 값을 뺀 값 (H피 -H아르 자형).
최종 엔탈피에서 초기 엔탈피를 뺀 값 (H에프 -H나는) 또는 반응이므로 생성물의 엔탈피 값에서 반응물의 엔탈피 값을 뺀 값 (H피 -H아르 자형).
열이 방출되면 에너지가 손실됩니다. 따라서 시스템의 총 에너지가 감소하므로 제품의 엔탈피가 항상 따라서 발열 반응의 엔탈피 변화는 항상 음의 값이됩니다. 제로 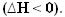
지금 멈추지 마세요... 광고 후 더 있습니다;)
일반적인 발열 반응 고려 :
| A → B + 열 |
이것은 아래와 같은 엔탈피 다이어그램을 사용하여 표현할 수 있습니다.
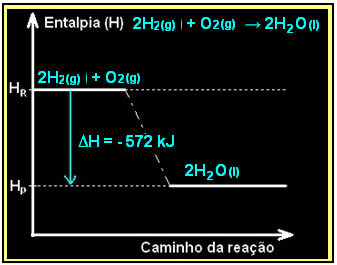
액체 물의 형성과 함께 수소 가스의 연소는 에너지 방출과 함께 발생합니다. 이 반응에서 시스템의 엔탈피 변동 값은 다음과 같이 제공됩니다.
2 시간2 (g) + O2 (g) → 하반기2영형(1)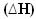 =-572 kJ
=-572 kJ
다이어그램은 다음과 같이 표시됩니다.
작성자: Jennifer Fogaça
화학 전공
이 텍스트를 학교 또는 학업에서 참조 하시겠습니까? 보기:
FOGAÇA, Jennifer Rocha Vargas. "발열 반응에서 엔탈피의 변화"; 브라질 학교. 가능: https://brasilescola.uol.com.br/quimica/variacao-entalpia-reacoes-exotermicas.htm. 2021 년 6 월 28 일 액세스.
화학

열화학, 엔탈피, 방출 열, 발열 반응, 연소 반응, 외부 환경, 흡열 반응, 반응 화학, 에너지 교환, 시약, 발광, 빛 흡수, 열, 전기, 구성 요소, 물리적 상태, 제품.


