가역적 및 비가 역적 프로세스의 개념은 엔트로피 개념을 사용하여 수학적으로 설명 할 수 있습니다. 그러나 엔트로피의 정의에 도달하기 전에 가역적 및 비가 역적 프로세스의 개념에 대해 살펴 보겠습니다. 우리는 부른다 가역 프로세스 시스템이 자발적으로 원래 상황 (또는 상태)으로 돌아갈 수있는 것입니다. 돌이킬 수없는 과정 시스템이 자발적으로 원래 상태로 돌아갈 수없는 시스템입니다.
프로세스 유형의 개념이 이미 언급되었으므로 엔트로피의 정의로 이동하겠습니다. 그만큼 엔트로피 of a system (S)은 시스템의 무질서 정도를 나타내는 척도입니다. 조직이 클수록 엔트로피가 낮아집니다. 엔트로피는 내부 에너지, 부피 및 몰 수와 마찬가지로 열역학적 상태의 특성입니다.
위 그림의 컨테이너를 보면 컨테이너 1에 엔트로피 다른 것보다 작습니다. 우리가 용기를 가져다가 흔들면“공”이 뒤섞이거나 오히려 무질서 해지는 지 확인할 것입니다. 용기 2를 확인하면 흔들어 주면 볼이 불가능하다는 것을 알 수 있습니다. 자발적으로 원래 조직으로 돌아갑니다. 컨테이너.
가역 등온 (온도가 항상 동일하게 유지되는) 가역 공정에서 엔트로피를 온도에 대한 열 (주었거나받은) 비율로 정의합니다. 따라서 등온 과정에서 엔트로피를 다음과 같이 나타냅니다.
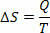
국제 단위계에서 우리는 줄 / 켈빈 단위로 엔트로피를 측정합니다. 엔트로피에 대해 설명하는 개념을 바탕으로 다음과 같이 제 2 법칙을 공식화 할 수 있습니다.

격리 된 시스템의 엔트로피 변경은 항상 양수 또는 null입니다. 등식 ΔS = 0은 프로세스가 가역적 일 때 발생합니다. 가역적 프로세스는 엔트로피를 증가시키지 않습니다. 환경에 열을 공급하지도 받지도 않는 격리 된 시스템은 엔트로피를 증가 시키거나 일정하게 유지할 수 있습니다.
Domitiano Marques 작성
물리학 졸업
브라질 학교 팀
출처: 브라질 학교- https://brasilescola.uol.com.br/fisica/entropia-segunda-lei.htm