ქიმიის შემსწავლელთათვის ერთ-ერთი ყველაზე დიდი გამოწვევაა ელექტრონული განაწილება. ის, რასაც ამ კონტექსტში ვაპირებთ, მნიშვნელოვნად შეუწყობს ხელს თქვენს კვლევებს, რომლებიც ეხება ელექტრონის კონფიგურაციას, რომელიც შემოთავაზებულია მეცნიერის ლინუს პაულინგის მიერ.
ელექტრონების მაქსიმალური რაოდენობა, რომელიც ჯდება თითოეულ ფენაში ან ენერგიის დონეზე, მოცემულია ცხრილის საშუალებით:
ენერგიის დონის ფენა ელექტრონების მაქსიმალური რაოდენობა
1-ლი K 2
მე -2 L 8
მე -3 M 18
მე -4 N 32
5 ° O 32
მე -6 P 18
მე -7 Q 8
ქვესნევების ენერგიის მზარდი რიგი არის დიაგონალების თანმიმდევრობის რიგი. Linus Pauling- ის დიაგრამა ნაჩვენებია ქვემოთ:
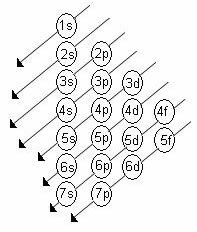
ძირითადი წესები:
1. ელემენტის ატომური ნომერი (Z) ნეიტრალურ მდგომარეობაში მიუთითებს ელექტრონების განაწილებაზე. ეს რიცხვი გამოსახულია ელემენტის სიმბოლოს ქვედა მარცხენა ნაწილში.
2. პაულინგის დიაგრამის გამოყენებით დაიწყეთ ელექტრონების განაწილება ზემოდან ქვემოთ, ენერგიის მზარდი რიგის გათვალისწინებით (ისრის მიმართულებით არის ორიენტირებული).
3. ქვესნევების შევსება ელექტრონების მაქსიმალური დონით. თუ მოცემული ქვესკნელი მხოლოდ 6 ელექტრონს ინახავს, არ გადააჭარბოთ ამ რაოდენობას.
4. შეამოწმეთ ელექტრონების რაოდენობა თითოეულ ქვექვეშეთში დამატებით.
მოდით პრაქტიკაში გამოვიყენოთ?
განაწილეთ რკინის ატომის ელექტრონები (Z = 26).
თუ ატომური რიცხვია 26, ეს ნიშნავს, რომ ნორმალური რკინის ატომში 26 ელექტრონია. პაულინგის დიაგრამის გამოყენებით გვექნება:

ლირია ალვესის მიერ
დაამთავრა ქიმია
წყარო: ბრაზილიის სკოლა - https://brasilescola.uol.com.br/quimica/regras-distribuicao-eletronica.htm
