ამერიკელი ქიმიკოსი გილბერტ ნ. ლუისმა (1875-1946) შემოგვთავაზა ოქტეტის წესი, სადაც ნათქვამია:
"სხვადასხვა ელემენტის ატომები ადგენენ ქიმიურ კავშირებს, აჩუქებენ, იღებენ ან უზიარებენ ელექტრონებს, ელექტრონული კონფიგურაციის მისაღებად. კეთილშობილი გაზი, ანუ ბოლო ელექტრონულად 8 ელექტრონი (ან 2 ელექტრონი იმ ატომების შემთხვევაში, რომლებსაც აქვთ მხოლოდ ერთი ელექტრონული გარსი, როგორც ეს ხდება წყალბადის) ".
1916 წელს ლუისმა თქვა, რომ დარჩეს სტაბილური და მიაღწიოს ოქტეტს ან დუეტს, იმ ელემენტებს, რომლებიც ქმნიან მოლეკულური ნივთიერებები შეასრულოს ელექტრონული წყვილების გაზიარება. ამ ნივთიერებებს მხოლოდ ატომები ქმნიან წყალბადის, არამეტალები და ნახევრად მეტალები, ყველა ერთად ელექტრონების მიღების ტენდენცია. ამიტომ, არ არსებობს რომელიმე მათგანისთვის ელექტრონის ჩუქების საშუალება (როგორც ეს ხდება იონურ ბმებში მეტალებთან), ყველამ უნდა მიიღოს, ამიტომ მათ ელექტრონებს უზიარებენ კოვალენტური ბმის ან მოლეკულური
ამრიგად, გილბერტ ლუისმა შემოგვთავაზა კოვალენტური ან მოლეკულური ბმის წარმოდგენის გზა, რომელიც ცნობილი გახდა, როგორც
ლუისის ფორმულა. მას ასევე ეძახიან ელექტრონული ფორმულა ან ჯერ კიდევ, ლუისის ელექტრონული ფორმულა, რადგან მისი მთავარი მახასიათებელია ის გვიჩვენებს ელექტრონები თითოეული ატომის ვალენტურ გარსში და ელექტრონული წყვილების წარმოქმნა.თითოეული ელექტრონი წარმოდგენილია წერტილით., რომელიც გარს აკრავს შესაბამისი ქიმიური ელემენტის სიმბოლოს. მხოლოდ ვალენტური გარსის ელექტრონებია ელემენტის გარშემო.
როგორც ნაჩვენებია ცხრილში, რომ იცოდეთ ელექტრონების რაოდენობა ვალენტურ გარსში, იცოდეთ პერიოდული ცხრილების ოჯახი:

ლუისის ფორმულაში, თითოეული გაზიარებული ელექტრონული წყვილი წარმოადგენს ქიმიურ (კოვალენტურ) ბმას, სადაც ელექტრონები ხვდებიან ელექტროსფეროს რეგიონში, რომელიც საერთოა ატომების თითოეული წყვილისთვის, რომლებიც გაერთიანებულია. ამიტომ, წარმოდგენაში, ისინი ერთმანეთის გვერდიგვერდ არიან განთავსებული.
მაგალითად, მოდით გაირკვეს, თუ რა არის ლუისის ფორმულა წყალბადის გაზისთვის, რომლის მოლეკულური ფორმულაა: H2.
წყალბადის თითოეულ ატომს აქვს მხოლოდ ერთი ელექტრონი ვალენტურ გარსში, რადგან ეს ელემენტი ეკუთვნის პერიოდული სისტემის 1 ოჯახს. თითოეულმა უნდა მიიღოს კიდევ ერთი ელექტრონი, რომ იყოს სტაბილური, ორი ელექტრონი K ელექტრონულ გარსში. ასე რომ, ისინი ანაწილებენ თავიანთ ელექტრონებს და ორივე იღებს ორს. შეხედე:
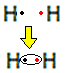
ეს არის წყალბადის გაზის მოლეკულის ლუისის ფორმულა.
ჟანგბადს აქვს ექვსი ელექტრონი თავის ელექტრონულ გარსში, ამიტომ თითოეულმა უნდა მიიღოს კიდევ ორი ელექტრონი, რომ იყოს სტაბილური, რვა ელექტრონი. ამიტომ, ჟანგბადის გაზის მოლეკულის ლუისის ფორმულაა:

იხილეთ, რომ არსებობს ორი ბმული, რადგან არსებობს ორი გაზიარებული წყვილი.
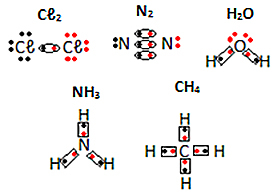
იხილეთ მოლეკულური ნივთიერებების ელექტრონული ფორმულების სხვა მაგალითები ქვემოთ:
ჯენიფერ ფოგაჩას მიერ
დაამთავრა ქიმია
წყარო: ბრაზილიის სკოლა - https://brasilescola.uol.com.br/quimica/formula-eletronica-lewis.htm


