ა ელექტროსფერო არის ატომის რეგიონი, რომელშიც ელექტრონები ისინი განლაგებულია. ელექტროსფერო, უფრო ზუსტად, შედგება ატომური ორბიტალებისგან, რომლებიც განისაზღვრება შროდინგერის განტოლების ამოხსნით. პირველად განსაზღვრული რეზერფორდის მოდელით, ელექტროსფერომ მნიშვნელოვანი წინსვლა მიიღო ბორის ატომური მოდელის მოქმედების პერიოდში.
ელექტროსფერო შეიძლება დაიყოს ფენებად (ან ენერგიის დონეებად), რადგან ელექტრონებს აქვთ განსაზღვრული (არაუწყვეტი) ენერგია. ორი ან მეტი ელექტრონის მქონე ატომებისთვის, გარსები იყოფა ქვეშელებად (ან ქვეშელებად). ელექტროსფერო ძალზე მნიშვნელოვანია ატომის თვისებების გასაგებად და ქიმიური ბმების წარმოქმნის გასაგებად.
წაიკითხეთ ასევე: როგორ ხდება ატომის გაყოფა?
თემები ამ სტატიაში
- 1 - ელექტროსფეროს შეჯამება
- 2 - ვიდეო გაკვეთილი ელექტროსფეროზე
- 3 - რა არის ელექტროსფერო?
- 4 - ელექტროსფეროს ფენები
- 5 - ელექტროსფეროს ფუნქცია
- 6 - კავშირი ელექტროსფეროსა და ატომის სტრუქტურას შორის
- 7 - ამოჭრილი სავარჯიშოები ელექტროსფეროზე
რეზიუმე ელექტროსფეროს შესახებ
ელექტროსფერო არის ატომის რეგიონი, რომელშიც ელექტრონები მდებარეობს.
იგი შედგება ატომური ორბიტალებისგან, ტალღური ფუნქციებისგან, რომლებიც შრედინგერის განტოლებების ამონახსნებია.
მისი კონცეფცია დაიწყო ერნესტ რეზერფორდის მოდელით.
ელექტრონები ინახება ელექტროსფეროში ატომის ბირთვისადმი მათი მიზიდულობის გამო.
მთავარი წინსვლა ელექტროსფეროს გაგებაში მოხდა ნილს ბორის მოდელის კონცეფციის დროს.
იგი შედგება ფენებისგან (ან ენერგიის დონეებისგან), რომლებიც განსაზღვრული ენერგიის რეგიონებია.
ერთზე მეტი ელექტრონის მქონე ატომებისთვის, გარსები იყოფა ქვეშელებად (ან ქვეშელებად).
ელექტროსფერო მნიშვნელოვანია რამდენიმე თვისების გასაგებად, როგორიცაა ატომური მსგავსება, სტაბილურობა, ატომური რადიუსი, იონიზაციის ენერგია, ელექტრონის აფინურობა, გარდა ობლიგაციების წარმოქმნის გაგების გარდა ქიმიკატები.
ვიდეო გაკვეთილი ელექტროსფეროზე
რა არის ელექტროსფერო?
ელექტროსფერო განისაზღვრება როგორც ატომური სტრუქტურის რეგიონი, რომელშიც ელექტრონები მდებარეობს. უფრო ღრმა ინტერპრეტაციებში ჩვენ ვამბობთ, რომ იგი შედგება ატომური ორბიტალებისგან, ტალღური ფუნქციებისგან, რომლებიც შრედინგერის განტოლების ამონახსნებია. ატომური ორბიტალის მათემატიკური გამოხატულება კვადრატში წარმოგვიდგენს ელექტრონის მდებარეობის ალბათობის სიმკვრივეს მოცემულ წერტილში.
ო ელექტროსფეროს კონცეფცია გაჩნდა ერნესტ რეზერფორდის ატომური მოდელი, რომელიც შეიცავს ელექტრონებს, რომლებიც ბრუნავს მკვრივი, დადებითი ბირთვის გარშემო. მოგვიანებით, ნილს ბორმა მოიტანა ელექტროსფეროს უფრო მნიშვნელოვანი ინტერპრეტაციები კვანტური მექანიკის ცნებების შერევით.
არ გაჩერდე ახლა... რეკლამის შემდეგ კიდევ არის ;)
ელექტროსფეროს ფენები
ელექტრონები ინახება ელექტროსფეროში ატომის ბირთვისადმი მათი მიზიდულობის გამო. თუმცა ცნობილია, რომ ეს ელექტრონები არიან გარსებში, რომელთა ენერგიები კარგად არის განსაზღვრული. ასეთ ფენებს ასევე შეიძლება ეწოდოს ენერგიის დონეები.
ეს დასკვნა გაკეთდა სპექტროსკოპიული ექსპერიმენტების შემდეგ. მაგალითად, როდესაც ელექტრო დენი მიემართება გაზ H-ს2 დაბალ წნევაზე სინათლე გამოიყოფა H2. ამ მდგომარეობაში წარმოიქმნება H იონები+ და ელექტრონები, რომლებიც დაუბრუნდებიან H იონებს+ და წარმოიქმნება H-ის აღგზნებული (ენერგიული) სახეობები+. ზედმეტი ენერგიის მოსახსნელად H იონები+ გამოყოფს ენერგიას ელექტრომაგნიტური გამოსხივების (სინათლის) სახით და რეკომბინირებულია H გაზად2 ისევ.
შეიძლება გახსოვთ, რომ როდესაც თეთრი სინათლე გადის პრიზმაში, ის იშლება უწყვეტ სპექტრად (ცისარტყელის მსგავსი); თუმცა, იგივე არ ხდება H-დან მომდინარე შუქზე2: როდესაც ასეთი გამოსხივება გადის პრიზმაში, H ემისიის სპექტრში შეინიშნება მხოლოდ ნათელი ხაზები განსაზღვრული ტალღის სიგრძით.2, რომელიც ცნობილია როგორც სპექტრული ხაზები.
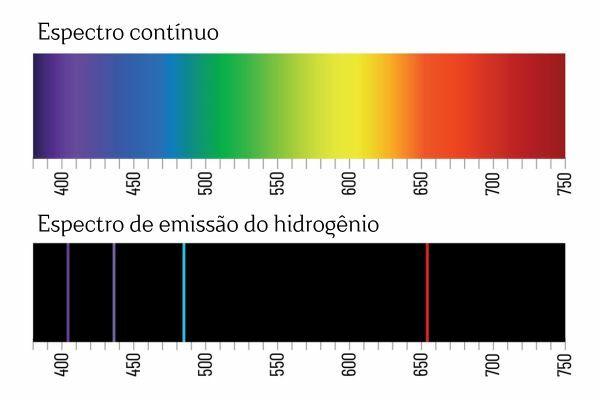
ელემენტების ემისიის სპექტრის ინტერპრეტაცია (კარგად განსაზღვრული სპექტრული ხაზებით) არის ის, რომ ელექტრონი, ატომში, არ შეუძლია წარმოადგინოს რაიმე ენერგია, არამედ კარგად განსაზღვრული რაოდენობით (ე.წ. ენერგიის პაკეტები). ელექტრონებს რომ არ ჰქონოდათ ასეთი ენერგეტიკული შეზღუდვები, ელემენტების ემისიის სპექტრი იქნებოდა უწყვეტი, ისევე როგორც პრიზმაში გამავალი თეთრი სინათლის სპექტრი.
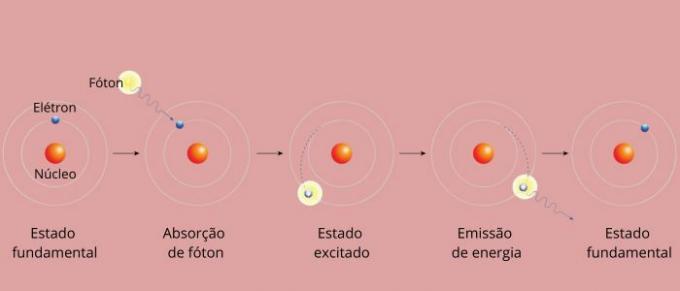
ელემენტის თითოეული სპექტრული ხაზი ცნობილი გახდა, როგორც ენერგიის დონე. (ან ფენა, როგორც ჩვენ უფრო ხშირად ვამბობთ). ეს ხაზები წარმოიქმნება, როდესაც ელექტრონი გადადის ერთი დაშვებული ენერგეტიკული დონიდან მეორეზე, ენერგიის ცვლილების პროცესში, რომელიც ცნობილია როგორც ელექტრონული გადასვლა.
ელექტრონული გადასვლის დროს, ელექტრონი გადადის დაბალი ენერგეტიკული დონიდან უფრო მაღალ ენერგეტიკულ დონეზე. საწყის დონეზე დაბრუნებისას ელექტრომაგნიტური გამოსხივების (სინათლის) მეშვეობით გამოყოფს ზედმეტ ენერგიას, რაც იძლევა წარმოშობის სპექტრული ხაზის, რომლის ენერგეტიკული მნიშვნელობა ემისიის პროპორციულია მნიშვნელობის განსაზღვრული განტოლებით რიდბერგი.
იოჰანეს რიდბერგი იყო შვედი სპექტროსკოპისტი, რომელმაც შექმნა განტოლება, რათა განესაზღვრა სპექტრული ხაზების ტენდენცია შვეიცარიელი პროფესორის იოჰან ბალმერის ნაშრომზე დაყრდნობით. თითოეული ფენის სპეციფიკური ენერგია განისაზღვრება შრედინგერის შესაბამისი განტოლების ამოხსნით.
თითოეულ ელექტრონულ ფენას აქვს დაშვებული ელექტრონების რაოდენობა. ამჟამად განსაზღვრულია შვიდი ელექტრონული ფენა, რომლებიც იდენტიფიცირებულია ასოებით K-დან Q-მდე, ანბანური თანმიმდევრობით, ან ასო n-ით, სადაც n ≥ 1. ამრიგად, ფენა K არის ფენა, სადაც n = 1 და ა.შ. თითო ჭურვიზე დაშვებული ელექტრონების რაოდენობა ნაჩვენებია შემდეგ ცხრილში.
ენერგიის დონე |
Ფენა |
ელექტრონების მაქსიმალური რაოდენობა |
1 |
კ |
2 |
2 |
ლ |
8 |
3 |
მ |
18 |
4 |
ნ |
32 |
5 |
ო |
32 |
6 |
პ |
18 |
7 |
ქ |
8 |
წყალბადის ატომებისთვის (მხოლოდ 1 ელექტრონით, როგორიცაა H, He+, ლი2+), ყველა ატომურ ორბიტალს აქვს ერთნაირი ენერგია (მათ გადაგვარებულ ორბიტალებს ვუწოდებთ); თუმცა, ორი ან მეტი ელექტრონის მქონე ატომებში წარმოიქმნება ძალიან მნიშვნელოვანი ეფექტი, ელექტრონ-ელექტრონის მოგერიება. ამ ფაქტის შედეგია ის, რომ ყოველი ფენის ორბიტალები იწყებენ სხვადასხვა ენერგიებს და, შესაბამისად, ფენების აღწერას იწყებს ქვეფენებად (ან ქვედონეებად).
მიმდინარე ატომებისთვის, თითოეული ფენა შეიძლება დაიშალოს ოთხამდე ქვედონედ, წარმოდგენილი ასოებით "s" (ინგლისურიდან, ბასრი), "p" (ინგლისურიდან, მთავარი), "დ" (ინგლისურიდან, დიფუზური) და "f" (ინგლისურიდან, ფუნდამენტური).
თითოეული ქვედონე მხარს უჭერს ელექტრონების მაქსიმალურ რაოდენობას, რომელიც განისაზღვრება გამოთვლებითა და ექსპერიმენტებით. "s" ქვედონე მხარს უჭერს 2 ელექტრონს; "p" ქვედონე, 6 ელექტრონამდე; "d" ქვედონე, 10 ელექტრონამდე; და "f" ქვედონე, 14 ელექტრონამდე. K ფენა ერთადერთია, რომელიც იძლევა მხოლოდ ერთ ორბიტალს და, შესაბამისად, აქვს მხოლოდ ერთი ქვედონე.
ენერგიის დონე |
Ფენა |
ქვედონეები |
1 |
კ |
1წ |
2 |
ლ |
2s, 2p |
3 |
მ |
3s, 3p, 3d |
4 |
ნ |
4s, 4p, 4d, 4f |
5 |
ო |
5s, 5p, 5d, 5f |
6 |
პ |
6s, 6p, 6d |
7 |
ქ |
7s, 7p |
ელექტროსფეროს ფუნქცია
თითოეული ატომის ელექტროსფერო შეიძლება გამოყენებულ იქნას ატომის სხვადასხვა თვისებებისა და ქცევის ასახსნელად.
ისეთ თვისებებს, როგორიცაა ატომური რადიუსი, იონური რადიუსი, იონიზაციის ენერგია და ელექტრონის აფინურობა, აქვთ მნიშვნელობები, რომლებიც უშუალო შედეგია ელექტროსფეროს ელექტრონული კონფიგურაციის, უფრო კონკრეტულად კი ვალენტურ გარსს უწოდებენ, რომელიც რეალურად არის ატომის ან იონის ყველაზე გარე დაკავებული ელექტრონული გარსი.
ა პერიოდულ სისტემაში ერთი და იგივე ჯგუფის ატომებს შორის მსგავსება ასევე არის ელექტრონული კონფიგურაციის შედეგი. სავალენტო გარსის. ქიმიურ პროცესებში ჩვენ ვირჩევთ ატომებს ერთი და იგივე ჯგუფიდან, რაც შეიძლება პერიოდულ ცხრილში შემცვლელები და ეს მხოლოდ დამაჯერებელია, რადგან ამ ატომებს აქვთ იგივე ელექტრონული კონფიგურაცია ფენაში ვალენტობის.
რომ ქიმიური ობლიგაციები, რომლებიც წარმოიქმნება ატომებს შორის იონური და კოვალენტური ნაერთების (მოლეკულების) წარმოქმნით, ასევე ხდება ატომების ელექტროსფეროებს შორის ურთიერთქმედების გზით.
წაიკითხე შენც: შროდინგერის ატომური მოდელი - ატომის აღწერის გზა კვანტური მექანიკის გამოყენებით
კავშირი ელექტროსფეროსა და ატომის სტრუქტურას შორის
როგორც აღინიშნა, ელექტროსფერო მოიცავს ატომის იმ რეგიონს, რომელშიც ელექტრონები შეიძლება მოიძებნოს. ელექტრონები, უფრო კონკრეტულად, განლაგებულია ატომურ ორბიტალებში, რომლებსაც აქვთ კვანტური გამოთვლებით განსაზღვრული ენერგია.
ელექტროსფერო არის ატომის სტრუქტურის უდიდესი რეგიონი, ვინაიდან ატომის ბირთვი ძალიან მცირეა. ატომს, როგორც ფეხბურთის სტადიონს, ბირთვი შეესაბამებოდა ბურთს მოედნის ცენტრში, ხოლო სტადიონის დანარჩენი ნაწილი იქნება ელექტროსფერო.
მიუხედავად ამისა, მასის თვალსაზრისით, ელექტროსფერო მცირე წვლილი შეაქვს. ვინაიდან ელექტრონების მასა პროტონებისა და ნეიტრონების მასაზე დაახლოებით 1836-ჯერ მცირეა, შეგვიძლია ვთქვათ, რომ ატომის თითქმის მთელი მასა კონცენტრირებულია ბირთვში.
ამოხსნილი სავარჯიშოები ელექტროსფეროზე
კითხვა 1
(Facisb 2023) ბორის მოდელში წყალბადის ატომისთვის ელექტრონს შეუძლია მხოლოდ გარკვეული ორბიტების დაკავება. ამ ორბიტების ზოგიერთი ნაწილი წარმოდგენილია ფიგურაში, სადაც n აღნიშნავს ენერგეტიკულ დონეებს, რომლებიც ელექტრონს აქვს თითოეულ ორბიტაზე.
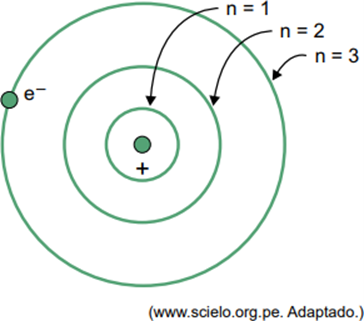
განვიხილოთ, რომ წყალბადის ატომში ელექტრონი არის ორბიტაზე, სადაც n = 5.
ბორის მოდელის მიხედვით, ეს ელექტრონი გამოყოფს ენერგიას ელექტრომაგნიტური გამოსხივების სახით მხოლოდ მაშინ
(ა) გადავიდეთ ორბიტაზე, რომელშიც n უდრის 6-ს.
(B) დარჩით ორბიტაზე, სადაც n = 5.
(C) გადასვლა ნებისმიერ ორბიტაზე, რომელშიც n 5-ზე მეტია.
(დ) გადასვლა ნებისმიერ ორბიტაზე, რომელშიც n 5-ზე ნაკლებია.
(E) გამოიდევნება ატომიდან, იონიზებს მას.
პასუხი: ასო D
როდესაც ელექტრონი გარე გარსშია, ქვედა ენერგიით შიდა გარსში დაბრუნებისას ის ათავისუფლებს ზედმეტ ენერგიას ელექტრომაგნიტური გამოსხივების (სინათლის) სახით. ამიტომ, სინათლის გაჩენა მოხდება მხოლოდ მაშინ, როდესაც n = 5-ში არსებული ელექტრონი გადადის შიდა გარსზე.
კითხვა 2
(Uerj 2019) ცოტა ხნის წინ, მეცნიერებმა მოახერხეს მეტალის წყალბადის წარმოება მაღალი წნევის ქვეშ მოლეკულური წყალბადის შეკუმშვით. ამ ელემენტის მეტალის თვისებები იგივეა, რაც პერიოდული კლასიფიკაციის ცხრილის პირველი ჯგუფის სხვა ელემენტები.
ეს მსგავსება დაკავშირებულია ამ ელემენტების ყველაზე ენერგიულ ქვედონესთან, რომელიც შეესაბამება:
(A) ns1
(B) n.p.2
(C) na3
(D) nf4
პასუხი: ასო ა
წყალბადის ატომს აქვს მხოლოდ ერთი ელექტრონი, რომელიც მდებარეობს პირველ დონეზე, ქვედონეზე „s“ (1s.1). ერთ-ერთი მიზეზი, რის გამოც ის გვხვდება პერიოდული ცხრილის 1 ჯგუფში, არის ის, რომ ამ ჯგუფის ყველა სხვა ქიმიურ ელემენტს აქვს ატომები, რომელთა ვალენტური გარსი არის იგივე ტიპის (ns1). მაშასადამე, მსგავსი ვალენტური ფენის გამო წყალბადის წარმოება ამ მეტალის სახით მოხერხდა.
წყაროები:
დო კანტო, ე. ლ. ლეიტე, ლ. ლ. ვ. კანტო, ლ. ვ. ქიმია - ყოველდღიურ ცხოვრებაში. 1. რედ. სან პაულო: მოდერნა, 2021 წ.
ატკინსი, პ. ჯონსი, ლ. ლავერმანი, ლ. ქიმიის პრინციპები: ცხოვრებისა და გარემოს კითხვა. 7. რედ. პორტო ალეგრე: ბუკმენი, 2018 წელი.
ატკინსი, პ. დე პაულა, ჯ. კილერი, ჯ. ატკინსის ფიზიკური ქიმია. 11 ed. ოქსფორდი: ოქსფორდის უნივერსიტეტის გამოცემა, 2018 წ.
გსურთ ამ ტექსტის მითითება სასკოლო ან აკადემიურ ნაშრომში? შეხედე:
NOVAIS, სტეფანო არაუხო. "ელექტროსფერო"; ბრაზილიის სკოლა. Ხელმისაწვდომია: https://brasilescola.uol.com.br/quimica/eletrosfera.htm. წვდომა 2023 წლის 10 ნოემბერს.