შექცევადი რეაქციები, როგორც წესი, იწყება გარკვეული რაოდენობის რეაგენტებით. პირდაპირი რეაქციის დაწყებისთანავე, დროთა განმავლობაში, ამ რეაგენტებს მოიხმარენ ფორმირებისთვის პროდუქტების, შესაბამისად, რეაგენტების კონცენტრაცია მცირდება, ხოლო პროდუქტების კონცენტრაცია იზრდება. შემდეგ, იწყება უკუპროექციაც, რეაქტიული ნივთიერებების წარმოებაც, სანამ პირდაპირი და შებრუნებული რეაქციების განვითარების სიჩქარე (სიჩქარე) იგივე არ დარჩება, მიაღწევს ე.წ. ქიმიური ბალანსი.
წონასწორობაში არის წონასწორობის მუდმივა Kc, რომელიც ძირითადად გამოხატულია შემდეგით:
|
Kc = [პროდუქტები]კოეფიციენტი დაბალანსებულ ქიმიურ განტოლებაში [რეაგენტები]კოეფიციენტი დაბალანსებულ ქიმიურ განტოლებაში |
ანუ შემდეგი ზოგადი წონასწორობის რეაქციის გათვალისწინებით:
a A + b B ↔ c C + d D
მას შემდეგ, რაც მცირე ასოები არის კოეფიციენტები, ხოლო დიდი ასოები არის ნივთიერებები, ამ რეაქციის წონასწორობის მუდმივა იქნება:
Kc = [ჩ]ჩ. [D]დ
[THE]. [B]ბ
ამის შესახებ დამატებითი დეტალები შეგიძლიათ იხილოთ ტექსტში Kc და Kp წონასწორობის მუდმივები. ეს ტექსტი ასევე გვაჩვენებს მნიშვნელოვან რამეს: რომ Kc მნიშვნელობებმა შეიძლება გვაჩვენოს არის თუ არა რეაგენტების კონცენტრაცია და ა.შ. პროდუქტები ტოლია ან თუ ერთი უფრო მეტია ვიდრე მეორე და, შედეგად, თუ ქიმიური ბალანსი გადაადგილებულია გარკვეული მიმართულებით რეაქცია
ასე რომ, ჩვენ უნდა დავადგინოთ Kc სიდიდე. ამისათვის გაითვალისწინეთ, რომ ეს გათვლები ექსპერიმენტულია, მოდით ვნახოთ რეაქციების რამდენიმე მაგალითი და მათგან მიღებული მონაცემები.
ამ გამოთვლების შესრულებისას ძალიან გამოსადეგია ცხრილის დაწერა მსგავსი ცხრილისა და მასში მითითებული ნაბიჯების შესრულება:

წონასწორობის მუდმივის გამოსათვლელად გამოყენებული მონაცემების ცხრილი
ახლა, მოდით, პრაქტიკაში წავიდეთ:
მაგალითი 1: დახურულ ჭურჭელში, 2 ლ ტევადობით, 100 ° C ტემპერატურაზე, არის 20 მოლი N2ო4. იწყება შემდეგი შექცევადი რეაქცია: ნ2ო4 ↔ არა2. გარკვეული დროის შემდეგ გაირკვა, რომ რეაქციამ მიაღწია ქიმიურ წონასწორობას და რომ 8 მოლ NO2 ჩამოყალიბებული ჰქონდა. რა მნიშვნელობა აქვს წონასწორობის მუდმივ Kc- ს 100 ° C ტემპერატურაზე?
რეზოლუცია:
მოდით გამოვიყენოთ ცხრილი:

წონასწორობა მუდმივი გაანგარიშების მაგალითის გადასაჭრელად
გაითვალისწინეთ, რომ იმ სტრიქონში, სადაც რეაგირებისა და ფორმის სიდიდეები იყო დაწერილი, ვიცით, რომ დაიხარჯა N 4 მოლი2ო4, რადგან თანაფარდობა არის 1: 2 და წარმოიქმნა 8 მოლი NO2.
ახლა უბრალოდ შეცვალეთ მნიშვნელობები ამ რეაქციის წონასწორობის Kc გამოხატვისას:
Kc = [იქ2]2
[ნ2ო4]
Kc = (4 მოლი / ლ) 2
(8 მოლი / ლ)
კკ = 2 მოლი / ლ
Kc– ს მნიშვნელობა არ არის განზომილებიანი, მას არ აქვს რაიმე სიდიდესთან დაკავშირებული ერთეული.
ახლა მოდით ვნახოთ მაგალითი, რომელიც ასევე შეიცავს პროდუქტებს თავიდანვე:
მაგალითი 2: დახურულ ჭურჭელში, 5 ლ მოცულობით, T ტემპერატურაზე, არის 2 მოლი წყალბადის გაზი, 3 მოლი იოდის გაზი და 4 მოლი წყალბადის იოდიდი. რეაქცია შედის ქიმიურ წონასწორობაში, T ტემპერატურაზე და აღმოჩნდება, რომ ჭურჭელში არის 1 მოლი წყალბადის გაზი. რა გრაფიკი წარმოადგენს ამ წონასწორობას და რა მნიშვნელობა აქვს წონასწორობის მუდმივ Kc- ს T ტემპერატურაზე?
რეზოლუცია:
ცხრილის გამოყენება:
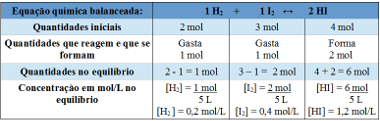
წონასწორობის მუდმივის დასადგენად გამოყენებული ცხრილი
დიაგრამა, რომელიც აჩვენებს რეაგენტების და პროდუქტების მოლ / ლ კონცენტრაციებში ცვლილებებს, სანამ ისინი წონასწორობას მიაღწევენ, შეიძლება მოცემული იყოს:

ქიმიური წონასწორობის გრაფიკი, რომელიც აჩვენებს რეაგენტების და პროდუქტების კონცენტრაციის ცვლილებებს
ახლა ჩვენ აღმოვაჩენთ წონასწორობის მუდმივის მნიშვნელობას:
Kc = __ [HI]2__
[ჰ2 ]. [ᲛᲔ2]
Kc = (1,2)2
0,2. 0,4
Kc = 18
ჯენიფერ ფოგაჩას მიერ
დაამთავრა ქიმია
წყარო: ბრაზილიის სკოლა - https://brasilescola.uol.com.br/quimica/calculo-constante-equilibrio-kc.htm

