ნაერთების ფიზიკური და ქიმიური თვისებების ანალიზი, რომლებიც ახდენენ კოვალენტურ კავშირებს (ელექტრონების გაზიარებით) გვაჩვენებს, რომ ამ მასალებს შორის დიდი განსხვავებებია. სანამ თავად დავაკვირდებით ამ მახასიათებლებს, ვნახოთ რა განსხვავებაა მოლეკულურ და კოვალენტურ ნივთიერებებს შორის.
საათზე მოლეკულური ნივთიერებები ესენი არიან ისეთები, რომლებიც წარმოიქმნება ატომების შეერთებისას კოვალენტური ობლიგაციების საშუალებით და წარმოქმნის განსაზღვრული რაოდენობის მოლეკულებს.
ამასთან, კოვალენტურ კავშირს ასევე შეუძლია წარმოქმნას ნაერთები ქსელის სტრუქტურაში, ატომების ძალიან დიდი და განუსაზღვრელი რაოდენობით, რომლებიც მაკრომოლეკულები. ასეთ ნივთიერებებს უწოდებენ კოვალენტური ნაერთები ან კოვალენტური ქსელის მყარი ნივთიერებები. ამ ნაერთების რამდენიმე მაგალითია: ალმასი (C), გრაფიტი (C), სილიციუმის დიოქსიდი (SiO)2) და სილიციუმის კარბიდი (SiC).
ახლა გადავხედოთ მის ძირითად თვისებებს:
- ფიზიკური მდგომარეობა ოთახის ტემპერატურაზე: ატმოსფერულ პირობებში გვხვდება მოლეკულური და კოვალენტური ნაერთები სამ ფიზიკურ მდგომარეობაში (მყარი, თხევადი და გაზი).
მაგალითები:
ო Მყარი: შაქარი (საქაროზა), სილიციუმი (ქვიშა), ბრილიანტი, გრაფიტი;
ო თხევადი: წყალი, აცეტონი, ეთანოლი;
ო გაზური: წყალბადის სულფიდი, ქლორის აირი, ბრომის აირი, წყალბადის გაზი.

- დნობის და დუღილის წერტილი: ზოგადად, ამ ნივთიერებების დნობისა და დუღილის წერტილებია იონურ ნივთიერებებზე ნაკლები.
კოვალენტურ ნივთიერებებს უფრო მაღალი ტემპერატურა აქვთ ვიდრე მოლეკულური, ყოველთვის 1000 ° C– ზე მეტი. ეს იმიტომ ხდება, რომ რადგან მისი მოლეკულები უფრო მჭიდროდ არის შეერთებული და წარმოქმნის კრისტალურ ქსელებს, საჭიროა მეტი ენერგიის მიწოდება, რათა მათ შეიცვალონ მდგომარეობა.
კოვალენტური და მოლეკულური ნაერთების დუღილის და დნობის წერტილებს ორი ფაქტორი უშლის ხელს: მოლური მასა და ინტერმოლეკულური ძალა.
რაც მეტია მოლური მასა, მით მეტია მოლეკულის ინერცია და, შესაბამისად, მით უფრო მაღალია დუღილის და დნობის წერტილი. თუ მოლური მასები დაახლოებულია, ჩვენ ვუყურებთ ინტერმოლეკულურ ძალებს. ყველაზე ინტენსიური ინტერმოლეკულური ძალაა წყალბადის შეერთება, რაც იწვევს დუღილის და დნობის მაღალ წერტილს. შუალედური არის მუდმივი დიპოლი და ყველაზე სუსტი, რაც იწვევს დუღილის და დნობის ქვედა წერტილს, არის გამოწვეული დიპოლი.
- ელექტრო მიმდინარე: სუფთა სახით, როგორც სითხეები, ასევე მყარი ნივთიერებები არ ახდენენ ელექტრულ დენას.
გამონაკლისს წარმოადგენს გრაფიტი, რომელიც ელექტრულ დენს ატარებს მყარი ფორმით, რადგან მისი ორმაგი ბმის ელექტრონები რეზონანსულია და, შესაბამისად, აქვთ გარკვეული მობილურობა.
- ხსნადობა: პოლარები იშლება პოლარებად და არაპოლარულები - პოლარებად.
- სიმტკიცე: კოვალენტური ნივთიერებების მდგრადობა ზემოქმედების ან მექანიკური შოკის მიმართ დაბალია. ზოგადად, ისინი მყიფე მყარია, როგორც ეს ნაჩვენებია მინის შემთხვევაში, რომელიც იქმნება ნატრიუმის და კალციუმის სილიკატებით.

- სიმტკიცე: ზოგადად, მათ აქვთ მაღალი სიმტკიცე. გრაფიტის გამოკლებით, რადგან მისი ნახშირბადის ატომები უკავშირდება ნახშირბადის კიდევ სამ ატომს, ქმნის გარკვეულ მობილურობას ექვსკუთხა ფირფიტებს, რაც მას რბილობს. ამის გამო, მას საპოხი საშუალებაც კი იყენებენ.
ამ ნივთიერებების სიმტკიცე იცვლება ბროლის ტიპის მიხედვით, როგორც ეს მოცემულია ქვემოთ მოცემულ ცხრილში:
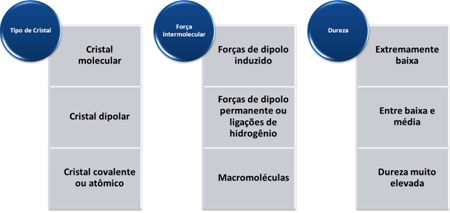
ჯენიფერ ფოგაჩას მიერ
დაამთავრა ქიმია
წყარო: ბრაზილიის სკოლა - https://brasilescola.uol.com.br/quimica/propriedades-dos-compostos-covalentes-moleculares.htm
