THE დისტილაცია არის ერთგვაროვანი ნარევების გამოყოფის მეთოდი, ანუ როდესაც კომპონენტები ერთ ფაზაშია.
არსებობს ორი სახის დისტილაცია. მარტივი დისტილაცია გამოიყენება მყარი-თხევადი გამოყოფისას და ფრაქციული დისტილაცია სითხეების ნარევში, რომლებიც ერთმანეთს ერევა.
ნარევის კონკრეტული კომპონენტის იზოლირების მიზნით, აუცილებელია ცვლადის შეცვლა. დისტილაციის შემთხვევაში გამოყოფა ხდება ტემპერატურის შეცვლით ისე, რომ ინტერესის კომპონენტი ცვლის ფიზიკურ მდგომარეობას.
ამ პროცესში გამოყენებული ნივთიერებების თვისებაა დუღილის წერტილი, ანუ ტემპერატურა, რომლის დროსაც ხდება თხევადიდან გაზზე ცვლილება.
დისტილაციის პროცესი
დისტილაციის პროცესი შედგება ნარევისთვის სითბოს მიწოდებისგან, სანამ არ მიიღწევა ინტერესის კომპონენტის დუღილის წერტილი და ის არ გადაიქცევა აირისებრ მდგომარეობაში, არ გამოიყოფა სხვებისგან.
ამის შემდეგ, გაზი გადის გამაგრილებელ სვეტში, სადაც სითბო გამოიყოფა ნივთიერებიდან, სანამ არ მიაღწევს დნობის წერტილს და, ამრიგად, არ დაუბრუნდება თხევად მდგომარეობას. ეს მასალა მიმართულია სხვა კონტეინერში.
მარტივი დისტილაცია
ერთგვაროვანი ნარევის გამოსაყოფად თხევადში გახსნილი მყარი გამოიყენება მარტივი დისტილაცია.
ქვემოთ მოცემულ სურათზე ჩვენ ვხედავთ გამოყოფის პროცესის ძირითად აღჭურვილობას.

არიან ისინი:
- დისტილაციის კოლბა (1), რომელიც შეიცავს ნარევს;
- გამათბობელი საბანი (2), რომელიც უზრუნველყოფს ნარევის სითბოს;
- თერმომეტრი (3), ტემპერატურის ცვლილების მონიტორინგისთვის;
- კონდენსატორი (4), აორთქლებული კომპონენტის გასაგრილებლად და
- ჭიქა (5), გამოყოფილი კომპონენტის თხევად მდგომარეობაში შესაგროვებლად.
ეს პროცესი შეიძლება გამოყენებულ იქნას, მაგალითად, ნატრიუმის ქლორიდის (NaCl) გამოსაყოფად, რომელიც ცნობილია როგორც სუფრის მარილი, და წყალი. მარილს აქვს დუღილის წერტილი 1465 °C და იხსნება წყალში ერთგვაროვანი ნარევის წარმოქმნით.
ვინაიდან წყალს აქვს 100 ºC დუღილის წერტილი, ის ადვილად გადადის აირისებრ მდგომარეობაში და გამოიყოფა ნარევიდან, მარილი კი კრისტალიზდება და მყარ მდგომარეობაში რჩება კონტეინერში.
წყლის ორთქლი გამოდის დისტილაციის კოლბის თავზე და გადის კონდენსატორში. ცივი ან ცივი წყალი ცირკულირებს ამ მოწყობილობის კედლებზე. სითხეებს შორის სითბოს გაცვლა იწვევს ნარევის გამოყოფილი კომპონენტის სითბოს დაკარგვას და თხევად მდგომარეობაში დაბრუნებას სხვა კონტეინერში შესაგროვებლად. ამ სითხეს დისტილატს უწოდებენ.
ფრაქციული დისტილაცია
ერთგვაროვანი ნარევის გამოსაყოფად ერთმანეთთან შერეული სითხეები ხოლო დუღილის ტემპერატურებს შორის დიდი სხვაობით გამოიყენება ფრაქციული დისტილაცია.
ეს მეთოდი ფრაქციულია, რადგან კომპონენტები გამოყოფილია ნარევიდან დუღილის აღმავალი წესიანუ, დაწყებული ყველაზე დაბალიდან მანამ, სანამ ის მოითხოვს უმაღლეს ტემპერატურას ფაზის შესაცვლელად.
ქვემოთ მოცემულ სურათზე არის მოწყობილობა, რომელიც გამოიყენება მეთოდის შესასრულებლად.
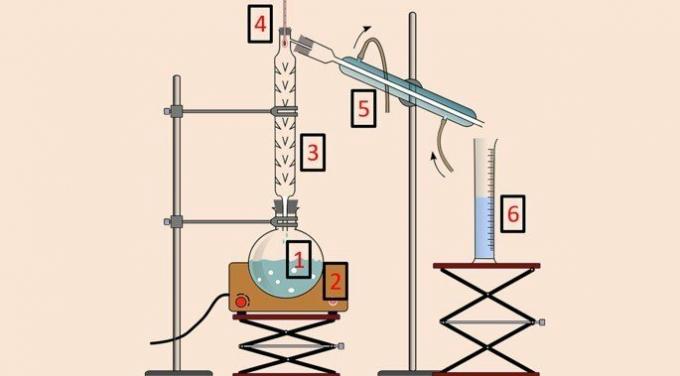
როგორც მარტივი დისტილაციისას, გამოიყენება დისტილაციის კოლბა (1), გამაცხელებელი საბანი (2), თერმომეტრი (4), კონდენსატორი (5) და ჭიქა (6). თუმცა, დისტილაციის ან ფრაქციების სვეტი (3) არის მოწყობილობა, რომელიც საშუალებას იძლევა განცალკევება ტემპერატურის მიხედვით.
დისტილაციის სვეტს აქვს მთელი რიგი დაბრკოლებები შიგნით, რათა არ მოხდეს ნარევის ყველა კომპონენტის ერთდროულად აორთქლება.
ეს პროცესი ფართოდ გამოიყენება ნავთობის ფრაქციების გამოსაყოფად, რომელიც არის ნახშირწყალბადების ნარევი. ნავთობის ზოგიერთი კომპონენტი და მათი შესაბამისი დუღილის წერტილები (PE) არის: ბუტანი (PE 20 ºC), ბენზინი (PE 150 ºC) და ნავთი (PE 300 ºC).
ფრაქციული დისტილაციით ბუტანი არის პირველი გამოყოფილი კომპონენტი, რადგან მას აქვს ყველაზე დაბალი დუღილის წერტილი, შემდეგ ბენზინი, შუალედური დუღილის წერტილით და ბოლოს ნავთი.
დისტილაციის აპლიკაციები
დისტილაცია ფართოდ გამოიყენება მრეწველობაში, რადგან ბევრი ნარევი გადის ამ პროცესს. მეთოდით მზადდება ისეთი ალკოჰოლური სასმელები, როგორიცაა ვისკი, კონიაკი და არაყი.
ნავთობქიმიური ინდუსტრია იყენებს ფრაქციულ დისტილაციას ნავთობის გადამუშავებისთვის. დისტილაციის კოშკები არის დიდი სტრუქტურები, რომლებიც შექმნილია ამ წიაღისეული საწვავის ფრაქციების გამოსაყოფად.

დისტილაციის ვარჯიშები
კითხვა 1
დისტილაცია არის თვისებებზე დაფუძნებული გამოყოფის მეთოდი.
ქიმია
ბ) ფიზიკა
გ) ბიოლოგიური
დ) საქმის გენერალური
ალტერნატივა: ბ) ფიზიკა.
დუღილის წერტილი არის მატერიის სპეციფიკური ფიზიკური თვისება, რადგან ის თანდაყოლილია მოცემულ ნივთიერებაში. ეს არის ტემპერატურა, რომლის დროსაც მასალა იცვლება თხევადი მდგომარეობიდან აირისებურ მდგომარეობაში, ანუ განიცდის აორთქლებას.
კითხვა 2
ეს არის დისტილაციით გამოყოფილი ნარევების მაგალითები, გარდა
ა) წყალი + აცეტონი
ბ) მარილწყალში
გ) წყალი + ზეთი
დ) ზღვის წყალი
სწორი ალტერნატივა: გ) წყალი + ზეთი.
წყალი და ზეთი შეურევადი ნივთიერებებია. ამ შემთხვევაში, დეკანტაციის მეთოდი გამოიყენება ნარევის კომპონენტების გამოსაყოფად. ეს მეთოდი ეფუძნება სიმკვრივის განსხვავებას.
მარილწყალს (წყალი + მარილი) და ზღვის წყალი, რომელსაც ასევე აქვს გახსნილი მარილები, გამოყოფენ მარტივი დისტილაციით. წყლისა და აცეტონისთვის გამოიყენება ფრაქციული დისტილაცია.
კითხვა 3
(UFRGS) ორფაზიანი ჰეტეროგენული სისტემა იქმნება სამი განსხვავებული სითხე A, B და C. ცნობილია, რომ:
A და B ერთმანეთს ერევა;
C შეუთავსებელია A-სთან და B-სთან;
A უფრო არასტაბილურია ვიდრე B.
ამ ინფორმაციის საფუძველზე, სამი სითხის გამოყოფის ყველაზე შესაფერისი მეთოდებია:
ა) ცენტრიფუგირება და დეკანტირება.
ბ) დეკანტაცია და წილადური დნობა.
გ) ფილტრაცია და ცენტრიფუგაცია.
დ) ფილტრაცია და ფრაქციული დისტილაცია.
ე) დეკანტაცია და ფრაქციული დისტილაცია.
სწორი ალტერნატივა: ე) დეკანტაცია და ფრაქციული დისტილაცია.
კითხვის ჰეტეროგენული სისტემა ორი ეტაპისგან შედგება:
ფაზა 1: სითხეები A და B, რომლებიც ერწყმის ერთმანეთს
ფაზა 2: სითხე C, რომელიც შეუთავსებელია სხვა კომპონენტებთან
ამიტომ, სიმკვრივის განსხვავების გამო, ფაზა 1 გამოყოფილია მე-2 ფაზისგან დეკანტაციის მეთოდით. დუღილის ტემპერატურის განსხვავების გამო, რადგან A უფრო აქროლადია ვიდრე B, ანუ ის ადვილად გადადის აირისებრ მდგომარეობაში, გამოიყენება ფრაქციული დისტილაცია.
მიიღეთ მეტი ცოდნა შინაარსით:
- მარტივი და ფრაქციული დისტილაცია
- ნარევების გამოყოფა
- სავარჯიშოები ნარევების გამოყოფაზე


