შენ ოქსიდები ისინი შედგება ორი განსხვავებული ელემენტისგან, რომელთაგან ერთი არის ჟანგბადი, რომელიც უნდა იყოს ორიდან ყველაზე ელექტრონეგატივი.
არაორგანული ოქსიდების ნომენკლატურა იცავს წესებს, რომლებიც დამოკიდებულია იმაზე, არის თუ არა ოქსიდი მოლეკულური, კოვალენტური თუ იონური. მოდით განვიხილოთ თითოეული შემთხვევა:
* მოლეკულური ოქსიდების ან კოვალენტური ქსელის ნომენკლატურა:
მოლეკულური ან კოვალენტური ქსელის ოქსიდები არიან ისეთები, რომლებსაც ჟანგბადი აქვთ მიერთებული ა ამეტალი, როგორიცაა ნახშირბადი (C), აზოტი (N), გოგირდი (S), ფტორი (F) და სხვა. ამ ოქსიდების ნომენკლატურა შემდეგ წესს ასრულებს:

ამეტალებით წარმოქმნილი ოქსიდების ნომენკლატურის წესი
ჟანგბადთან დაკავშირებული ელემენტის წინა მონო პრეფიქსი არასავალდებულოა.
მაგალითად, ჩვენ გვაქვს შემდეგი მოლეკულური ოქსიდი: CO.
- პრეფიქსი, რომელიც მიუთითებს ჟანგბადის ოდენობაზე: 1 ჟანგბადი: მონო;
- ოქსიდი;
- პრეფიქსი, რომელიც მიუთითებს სხვა ელემენტის ატომების რაოდენობაზე: 1 ნახშირბადი: მონო;
- ჟანგბადთან დაკავშირებული ელემენტის დასახელება: ნახშირბადის.
ასე რომ, თქვენი სახელი ასეთია: CO = მონო ნახშირბადის მონოქსიდი ან ნახშირბადის მონოქსიდი.
იხილეთ მეტი მაგალითები:
ნახშირორჟანგი - CO2
გოგირდის ტრიოქსიდი - SO3
დიქლორო ჰეპტოქსიდი - Cl2ო7
დინიტროგენის მონოქსიდი - N2ო
დინიტროგენის ტრიოქსიდი - N2ო3
აზოტის მონოქსიდი -NO
აზოტის დიოქსიდი - არა2
დინიტროგენული პენტოქსიდი - N2ო5
სილიციუმის დიოქსიდი - SiO2
დიფოსფორის პენტოქსიდი - პ2ო5
გოგირდის ტრიოქსიდი - SO3
* იონური ოქსიდების ნომენკლატურა:
იონური ოქსიდები არის ის, ვისაც ჟანგბადი უკავშირდება ა მეტალი, როგორიცაა რკინა (Fe), ტყვია (Pb), ნატრიუმი (Na), კალციუმი (Ca), ვერცხლი (Ag) და სხვა. საერთოდ, ჟანგბადის ელექტრული მუხტი არის -2.
ნომენკლატურა, რომელიც მოლეკულური ან კოვალენტური ქსელის ოქსიდებისათვის არის ნახსენები, ამჟამად ასევე გამოიყენება მეტალის ოქსიდებზე და ოფიციალურად ითვლება.. იხილეთ რამდენიმე მაგალითი:
რკინის მონოქსიდი - FeO
ტყვიის მონოქსიდი - PbO
ტყვიის დიოქსიდი - PbO2
მრავალფეროვანი ტრიოქსიდი - Fe2ო3
ამასთან, ლითონის ოქსიდების სპეციფიკური ნომენკლატურა არსებობს, რომელიც კვლავ ფართოდ გამოიყენება. იგი ემყარება ჟანგბადთან დაკავშირებული ელემენტის ვალენტობას.
თუ ელემენტს აქვს ერთი ვალენტობა, ანუ, თუ არსებობს ჟანგბადის დასაკავშირებლად და მხოლოდ ერთი ტიპის ოქსიდის წარმოქმნის მხოლოდ ერთი გზა, დასახელების წესი მოცემულია შემდეგით:

ერთვალენტიანი იონური ოქსიდების დასახელების წესი
მაგალითები:
- ნატრიუმის ოქსიდი - Na2ო
- კალციუმის ოქსიდი - CaO
- კალიუმის ოქსიდი - კ2ო
- ალუმინის ოქსიდი - ალ2ო3
- ვერცხლის ოქსიდი - აგ2ო
მაგრამ არსებობს იონური ოქსიდებიც, რომლებსაც ელემენტები ქმნიან ერთზე მეტი ვალენტობა. ამ შემთხვევებში დასახელების წესი შემდეგია:
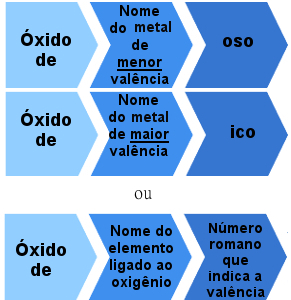
იონური ოქსიდების ნომენკლატურის წესი ერთზე მეტი ვალენტობით
მაგალითები:
შავი ოქსიდი - FeO
რკინის ოქსიდი - Fe2ო3
კუპრის ოქსიდი - Cu2ო
კუპრის ოქსიდი - CuO
ან:
რკინის ოქსიდი II - FeO (Iron nox = +2)
რკინის ოქსიდი III - Fe2ო3 (რკინის nox = +3).
სპილენძის ოქსიდი I - Cu2O (რკინის nox = +1)
სპილენძის ოქსიდი II - CuO (რკინის nox = +2).
ჯენიფერ ფოგაჩას მიერ
დაამთავრა ქიმია
წყარო: ბრაზილიის სკოლა - https://brasilescola.uol.com.br/quimica/nomenclatura-dos-oxidos.htm

