საათზე ინტერმოლეკულური ძალები, ზოგადად უწოდებენ ვან დერ ვაალის ძალებიარსებობს სამი: გამოწვეული დიპოლით გამოწვეული დიპოლი, წყალბადის ობლიგაციები და მუდმივი დიპოლური მუდმივი დიპოლი. ამ ტექსტში განვიხილავთ მხოლოდ ამ სამი ძალადან მხოლოდ უკანასკნელს:
Ძალა მუდმივი დიპოლური-მუდმივი დიპოლი, ან უბრალოდ, დიპოლური-დიპოლური ხდება მხოლოდ პოლარული მოლეკულები, ანუ ის, ვისაც არ აქვს დატვირთვის ერთიანი განაწილება მისი ზედაპირის გასწვრივ. მაგალითად რომ მოვიყვანოთ, HCl (მარილმჟავური აირი) მოლეკულაში ელექტრონული ღრუბელი უფრო გადაადგილებულია ქლორის ატომისკენ, რადგან იგი უფრო ელექტრონეგატიულია ვიდრე წყალბადის.
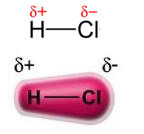
გაითვალისწინეთ, რომ ქლორის ატომის გარშემო ხდება ელექტრონების დაგროვება, რაც იწვევს ა უარყოფითი პოლუსი, რაც სიმბოლოა ბერძნული ასო დელტით (-δ). შედეგად, წყალბადის ატომის მიმდებარე რეგიონში ა პოზიტიური პოლუსი (+δ), რადგან მას აქვს დაბალი ელექტრონული სიმკვრივე. HCl მოლეკულა შემდეგ წარმოადგენს ა ელექტრო დიპოლი ამიტომ, სხვა მეზობელ HCl მოლეკულებთან კონტაქტის დროს, მოლეკულების საპირისპირო პოლუსებს შორის არის მიზიდულობის ძალა, როგორც ეს ქვემოთ ჩანს:
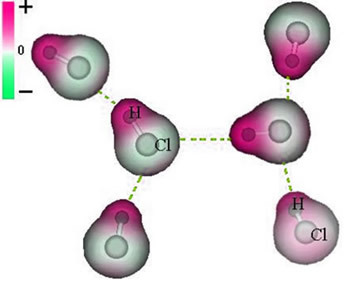
ეს მიმზიდველი ძალა, რომელიც დამყარებულია ერთი მოლეკულის დიპოლის ნეგატიურ დაბოლოებას შორის სხვა მოლეკულის დიპოლის პოზიტიურ დაბოლოებასთან, წარმოადგენს დიპოლ-დიპოლური ძალას..
ასე რომ, როგორც სახელი ამბობს, დიპოლი მუდმივია, ამიტომ ის მხოლოდ პოლარულ ნაერთებში გვხვდება. და რაც უფრო მაღალია მოლეკულის პოლარობა, მით უფრო ინტენსიურია დიპოლ-დიპოლური ურთიერთქმედება ნივთიერებაში.
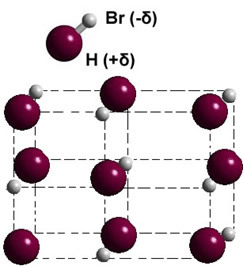
თუ ის მყარ ფაზაშია, მუდმივი დიპოლის ფორმირება ხელმძღვანელობს თითოეული მოლეკულის მდგომარეობას სივრცეში და წარმოიქმნება დიპოლარული კრისტალები; როგორც წყალბადის ბრომიდის შემთხვევაში, ილუსტრირებულია ქვემოთ:
პოლარული ნივთიერებების სხვა მაგალითები, რომლებსაც აქვთ დიპოლ-დიპოლური ძალა მათ მოლეკულებს შორის, არის: H2S, CO, HCCl3მხოლოდ2.
ეს ინტერმოლეკულური ძალაა საშუალო ინტენსივობა, ვინაიდან ის უფრო ძლიერია ვიდრე ინდუცირებული დიპოლით გამოწვეული დიპოლური მიზიდულობის ძალა, მაგრამ ნაკლებად ინტენსიურია ვიდრე წყალბადის ბმა. ამიტომ მათი დნობისა და დუღილის წერტილები უფრო მაღალია, ვიდრე იმ ნივთიერებების, რომლებსაც აქვთ გამოწვეული დიპოლური სიძლიერე. ვინაიდან მუდმივი დიპოლური ძალა უფრო ძლიერია, საჭიროა მეტი ენერგიის მიწოდება მისი მოლეკულების ურთიერთქმედების დასაშლელად.
ჯენიფერ ფოგაჩას მიერ
დაამთავრა ქიმია
წყარო: ბრაზილიის სკოლა - https://brasilescola.uol.com.br/quimica/forca-intermolecular-dipolo-dipolo.htm