炭素はその価電子殻に4つの電子を持っています。つまり、4つの結合を形成できるため、他の原子と結合できます。 として:H、O、N、Cl。 炭素が持つこの性質は、自然界に存在するさまざまな有機化合物を説明しているため、炭素は 四価。
1874年、ヴァントホフとルベルは炭素の空間モデルを作成しました。 このモデルには、通常の四面体で表される炭素原子があり、炭素は四面体の中心を占め、その4つの原子価は4つの頂点に対応しています。

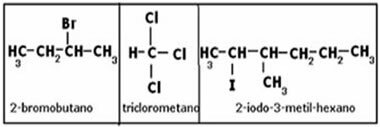
炭素の空間式。
このモデルでは、炭素原子間で発生するさまざまな種類の結合は次のように表されます。
) シンプルなリンク -四面体は頂点(単結合)で接続されています。


b)二重結合 -四面体は2つの頂点(エッジ)で結合されています。


c)トリプルリンク -四面体は3つの頂点(1つの面)で結合されています。
今やめないで... 広告の後にもっとあります;)


原子モデルの進化は、原子が核とエレクトロスフィアを持っていることを示し、それが新しいモデルの出現を可能にしました 炭素によって作られた結合を説明するために:1915年に、ルイスはの原子の結合のための新しい提案を提示しました 炭素。 ルイスによれば、原子価層の電子対を介して結合した原子。 この表現はルイス電子式と呼ばれ、原子が電子ペアを介して結合する結合のタイプは共有結合として知られています。
ルイスエレクトロニックフォーミュラ
有機分子の大部分は3次元であるため、構造だけでなく形状も示すモデルを使用する必要があります。 したがって、空間式は炭素の構造を理解するのにより適しています。
リリア・アルベス
化学を卒業
ブラジルの学校チーム
有機化学 - 化学 - ブラジルの学校
学校や学業でこのテキストを参照しますか? 見てください:
SOUZA、LíriaAlvesde。 "炭素構造式"; ブラジルの学校. で利用可能: https://brasilescola.uol.com.br/quimica/formulas-estruturais-carbono.htm. 2021年6月28日にアクセス。