何千もの有機化合物があるので、異性の現象はいくつかの形をとることができます。 したがって、異性は基本的に2つのタイプに分類できます。 フラットまたは体質異性 そして 空間異性または立体異性. 次の図に示すように、言及されている各タイプは細分化できます。
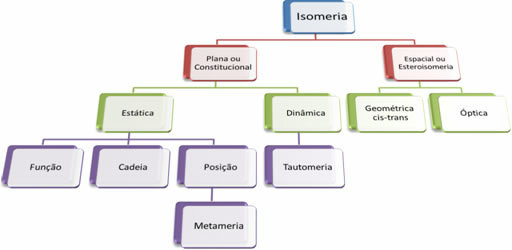
それぞれのケースを参照してください。
1. フラットまたは憲法上の異性: このタイプの異性体は同じ分子式を持ち、フラットな構造式で区別されます。 平面異性には、機能、鎖、位置、メタメリズム、互変異性の5つのケースがあります。
1.1.機能的または機能的異性: 異性体の違いは官能基にあります。
例:分子式C3H6O
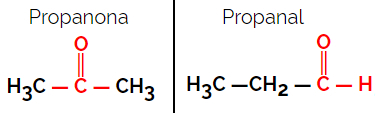
プロパノンはケトン基に由来し、プロパナールはアルデヒド基に由来することに注意してください。
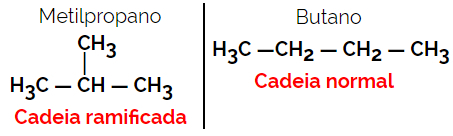
1.2. 鎖または骨格異性体: 異性体の違いは鎖の種類にあります。 たとえば、一方の異性体が開鎖でもう一方が閉鎖であるか、一方が通常鎖でもう一方が分岐鎖であるか、一方が均一鎖でもう一方が不均一鎖です。
例:分子式C4H10
1.3.位置的または位置的異性: 違いは、不飽和、官能基、ヘテロ原子または置換基の位置にあります。
例:分子式C4H6

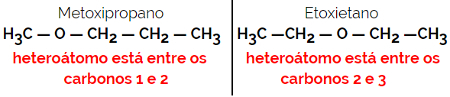
1.4.補償異性またはメタメリー: これは特殊なタイプの位置異性であり、違いはヘテロ原子の位置です。
例:分子式C4H10O
1.5.動的異性体または互変異性: これは特殊なタイプの機能異性であり、異性体は溶液中で動的平衡状態で共存します。 互変異性体の2つの主なタイプは、ケトンとエノールの間(ケトエノールバランス)と、アルデヒドとエノールの間(アルドエノールバランス)です。
例:分子式C3H6O
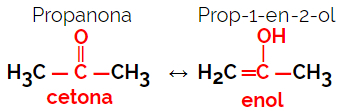
2. 空間異性または立体異性: この場合、異性体間の違いは、空間内の原子の向きによってのみ視覚化できます。 立体異性には、幾何異性と光学異性の2種類があります。
2.1.幾何異性体またはシス-トランス異性体:違いは、 シス 平面の同じ側の二重結合または環状化合物に同じ炭素配位子があります。 異性体配位子 トランス 反対側にあります。
例:分子式C2H2Cl2

これらの化合物はと呼ばれます 立体異性体。
2.2.光学異性体: 異性体が偏光ビームを偏向できる場合に発生します。 偏光ビームを左に曲げる場合は左旋性異性体ですが、右に曲げる場合は右巻き異性体と呼ばれます。
例:
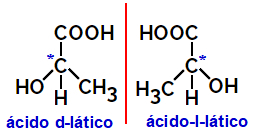
上に示したような非対称分子は、互いに鏡像であり、重ね合わせることができないものと呼ばれます。 エナンチオマー.
ジェニファー・フォガサ
化学を卒業
ソース: ブラジルの学校- https://brasilescola.uol.com.br/quimica/tipos-isomeria.htm

