エントロピーは 偉大熱力学 と関連した 不可逆性 物理システムの状態の。 それは一般的に "の程度に関連付けられています障害」または「ランダム性システムの」。 の声明の1つによると 熱力学の第二法則:
“熱的に隔離されたシステムでは、エントロピーの測定値は、最大値に達するまで、時間の経過とともに常に増加する必要があります。」
言い換えれば、 エントロピ 「の意味を測ることができます時間の矢システムの」。 以下の画像を見ると、システムの初期状態が次の画像で表されていることが直感的にわかります。 左、最大の 組織:
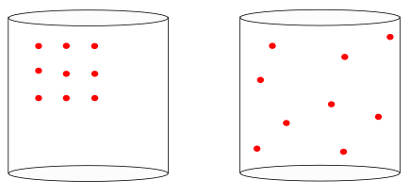
前の画像を見ると、最も可能性の高い最終構成は、原子が持っている構成であることがわかります すべての方向の速度、 及び ランダムな位置. それがエントロピーのすべてです。 多重度 システムの状態の 常に増加する必要があります.
例
以下の設定のどれが より可能性が高い 時間の経過とともにレンガの配置を観察する必要がありますか?

最初の構成では、 多重度 ブロックの状態の 少し:それらはすべてに配置されています 方向水平, 平行 お互い。 時間の経過やエージェントの行動により、その構成が期待されます 成長する に 数 に 州、 月曜コンフォメーション、右の画像に示されています。 他の例をあげることができます:
保冷剤を入れたとき より大きい温度、その温度はそれがに達するまで上昇します 熱バランス. その時点で、氷は溶ける可能性があります。 現在の状態にある氷塊から再び熱を奪うことによって 液体、 それは再び固体になることができますが、そのコンフォメーション 同じ組織にはなりません 以前に提示したもの。
香水のボトルを開けるとき、熱は助けることができます 拡散 あなたの 分子、 香水の内容物を部屋の全長に広げます。 熱を除去しても分子がフラスコに戻るのを促進しないため、逆のことは期待できません。
エントロピーの数学的定義
THE 数学的定義 エントロピーの割合は、熱量の比率で与えられます(Q)断熱システムの2つの部分の間で転送されます。 ジュール (J)、その絶対温度によって、 ケルビン (K):

S =エントロピー(J / K)
ΔQ =熱量(J)
T =絶対温度(K)
上記の定義は、 等温プロセスつまり、熱交換が非常に小さい(または遅い)ため、システムの温度を変更できない場合です。 したがって、エントロピーの定義は次のとおりです。 無限小 (無限に小さい部分)。
また、エントロピーの概念は次のように理解できます。同じガスの2つの部分によって形成されるシステムである。 多くの異なる温度、ある程度の抽出が可能です 作業 彼のいくつかを動かす ピストン または ハンドクランク、 例えば。 しかしながら、 時間とともに、このガスの部分は 残高熱の。 そこにすべてのエネルギーが存在していても、温度差がなくなった場合、それを抽出することはできません。 作業有用 彼から。
RafaelHellerbrock著
物理学を卒業
ソース: ブラジルの学校- https://brasilescola.uol.com.br/o-que-e/fisica/o-que-e-entropia.htm