NS 溶解度次のように定義できます 特定の温度で特定の量の溶媒に溶解できる溶質の可能な最大量。
溶解できるこの最大量は、 溶解係数 また 溶解度. しかし、物質の溶解度は、とりわけ、溶質が分散している溶媒の種類に依存します。
たとえば、NaCl(塩化ナトリウム-食卓塩)は水に非常に溶けやすく、20ºCの水1 Lに、この塩を最大360グラムまで可溶化できます。 しかし、同じ体積、温度、圧力の条件下で、溶媒がガソリンに変わると、塩は溶解しません。
物質の溶解度が溶媒ごとに大きく異なるのはなぜですか?
要因の1つは 極性 関与する化合物の。 引用した例では、 塩は極性、水は極性、ガソリンは無極性です。 塩は、ナトリウム(Na)と塩素(Cl)の原子によって形成され、イオン結合を介して結合します。ナトリウムは塩素に電子を確実に供与し、Naイオンを形成します。+ とCl-. これらのイオンは反対の電荷を持っているため、引き付けて一緒に保持します(Na+NS-).

これは、化合物の電荷に違いがあるため、塩が本当に極性であり、すべてのイオン結合が極性であることを示しています。
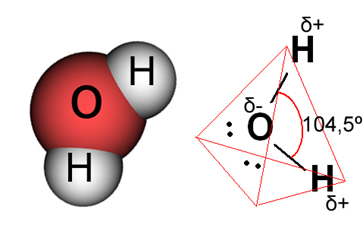
水の場合、既存の結合は共有結合であり、2つの水素原子が酸素原子と電子を共有します。 水分子には2つの双極子があり、酸素は部分的に負の電荷を持ち、水素は部分的に正の電荷を持ちます(δ- O─Hδ+). しかし、水分子が104.5度の角度で交わるため、これらの双極子は互いに打ち消し合いません。これは、分子に沿った分布と電荷が均一ではないことを示しています。 分子の酸素原子には、より大きな負電荷密度があります。 これは、水分子が本当に極性があることを示しています。
今やめないで... 広告の後にもっとあります;)
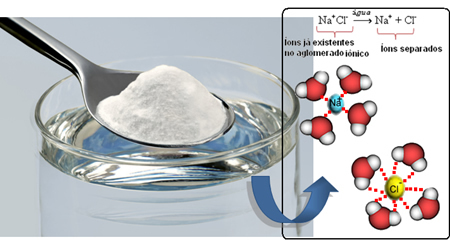
したがって、塩を水に混ぜると、塩の正の部分であるNaカチオンが生成されます。+は、酸素である水の負の部分と塩の負の部分(Cl陰イオン)に引き付けられます-)は水の正の部分に引き付けられます(H+). その結果、組合Na+NS- それは砕かれ、塩を水に溶かします。
一方、ガソリンは、無極性の異なる炭化水素の混合物によって形成されます。つまり、ガソリンの電荷の分布は均一です。 したがって、塩イオンとガソリンとの相互作用はなく、溶解しません。
これらおよび他の同様のケースは、次の結論につながります。

ただし、極性溶媒によく溶解する非極性溶質の場合が多く、その逆もあるため、これは一般的な規則とは見なされません。 したがって、これが発生する理由を理解するには、さらに別の要因を考慮する必要があります。 分子間力 溶媒と溶質の。
本文中のこれに関する法律: "分子間強度と物質の溶解度の関係”.
ジェニファー・フォガサ
化学を卒業
学校や学業でこのテキストを参照しますか? 見て:
FOGAÇA、ジェニファー・ロシャ・バルガス。 "物質の極性と溶解度の関係"; ブラジルの学校. で利用可能: https://brasilescola.uol.com.br/quimica/relacao-entre-polaridade-solubilidade-das-substancias.htm. 2021年7月27日にアクセス。



