一定温度での次の化学平衡を考慮してください。
3時間2(g) + N2(g) ↔2NH3(g)
ゲイ・リュサックによれば、反応におけるガス状の参加者の体積の比率は、それぞれの化学量論係数の比率に等しい。 簡単に言えば、反応物と生成物に存在する分子の数は、方程式の係数に等しいと言えます。
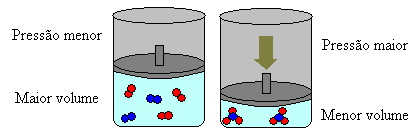
上記の場合、試薬には4つの分子があり、製品には2つの分子があります。これは、試薬の体積が大きく、生成物の体積が小さいことを意味します。
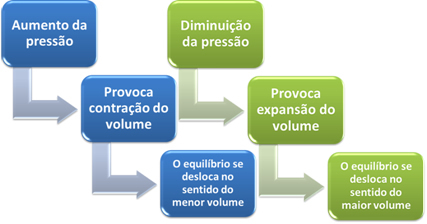
このシステムの圧力を上げると、バランスはより小さな体積にシフトし、この圧力を下げます。 私たちが検討している反応の場合、変位は生成物形成の直接方向になります(NH3(g)).
ただし、圧力を下げると、反応は反応物の形成の最大体積、つまり逆方向に移動します(3 H2(g) + N2(g)).
今やめないで... 広告の後にもっとあります;)
これは、ルシャトリエの原理に従って起こります。ルシャトリエの原理では、障害(圧力の増減など)が発生したとされています 平衡状態にあるシステムでは、この外乱を最小限に抑える方向に移動し、新しいシステムに再調整します。 残高。
簡単に言えば、化学平衡に対する圧力変動の影響の場合、次のように言うことができます。
反応物の体積が生成物の体積に等しい反応の場合、化学平衡は変化しません。
ジェニファー・フォガサ
化学を卒業
学校や学業でこのテキストを参照しますか? 見てください:
FOGAÇA、ジェニファー・ロシャ・バルガス。 "圧力の変動と化学的バランスの変位"; ブラジルの学校. で利用可能: https://brasilescola.uol.com.br/quimica/variacao-pressao-deslocamento-equilibrio-quimico.htm. 2021年6月28日にアクセス。
化学

あなたの知識をテストし、化学物質のバランスに関する解決された演習のこのリストで詳細を学びましょう。 この資料を通じて、平衡定数(Kp、Kc、Ki)、平衡シフト、pH、pOH、およびいわゆる緩衝液での平衡の操作方法をよりよく理解できるようになります。


