酸化還元反応の主な際立った特徴は、1つの化学種が(酸化によって)電子を失い、別の化学種が(還元によって)電子を獲得することです。
しかし、特定の反応では、酸化および/または還元だけではないことを観察することが可能です。 以下に例を示します。
SnS + HCl + HNO3 →SnCl4 + S + NO + H2O
「酸化数(Nox)の決定」というテキストで教えられているように、この反応のすべての原子の酸化数(Nox)を計算すると、次のようになります。
+2 -2 +1 -1 +1 +5 -2 +4 -1 0 +2 -2 +1 -2
SnS + HCl + HNO3 →SnCl4 + S + NO + H2O
どれを確認しましょう物質はそのNoxにばらつきがあり、その結果、酸化および還元されました。
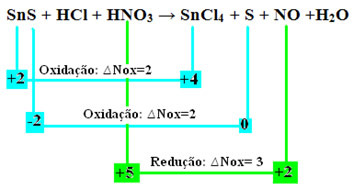
2つの酸化が発生したことに注意してください。 それで、その場合、化学反応式のバランスをとるにはどうすればよいですか?
すべてのレドックス反応に適用されることを覚えておくべき重要なことの1つは 与えられる電子の数は、常に受け取られる電子の数と等しくなければなりません。
したがって、このタイプの反応のバランスをとるには、テキスト「レドックスバランシング」ただし、変更点は1つだけです。 2つの酸化(SnS)を生成した種のNox変動(ΔNox)の決定は、2つのΔNoxの合計になります。これにより、失われた電子の合計値が得られます。
- SnS:∆Total Nox =(∆Nox SnCl4)+(ΔNoxS)
SnS:∆Total NOx = 2 + 2 = 4
- HNO3:∆Nox = 3
したがって、バランスを取るために次の手順に進むことができます。
- SnS:∆Total NOx = 4→ 4 HNO係数になります3;
- HNO3:∆Nox = 3→ 3 SnSの係数になります。
3 SnS + HCl + 4 HNO3 →SnCl4 + S + NO + H2O
試行方法によるバランシングの継続:
- 1番目のメンバーに3つのSnと3つのSがあるため、これらは2番目のメンバーの係数にもなります。
3 SnS + HCl + 4 HNO3 → 3 SnCl4 + 3 Y + NO + H2O
- それで、2番目のメンバーは12 Cl(3。 4 = 12)、したがって、12は、Clが最初のメンバーに含まれる物質の係数であるHClになります。
3 SnS + 12 HCl + 4 HNO3 →3SnCl4 + 3 S + NO + H2O
- これで、最初のメンバーに16 H(12 + 4 = 16)があるため、Hの係数は28に水素指数(2)を掛けると、16が得られるため、Oは8に等しくなります。
3 SnS + 12 HCl + 4 HNO3 →3SnCl4 + 3 S + NO +8NS2O
- さらに、1番目のメンバーにも4 Nがあるため、4は2番目のメンバーのNの係数にもなります。
3 SnS + 12 HCl + 4 HNO3 →3SnCl4 + 3 S + 4 NO +8 H2O
第1肢の酸素量に注意してください(3。 4 = 12)は、第2肢のその要素の合計量(4 + 8 = 12)に等しくなります。 したがって、反応はバランスが取れています。
ジェニファー・フォガサ
化学を卒業
ソース: ブラジルの学校- https://brasilescola.uol.com.br/quimica/reacoes-com-mais-uma-oxidacao-ou-reducao.htm
