融点と沸点は、物質が特定の圧力で状態を変化させる温度を表します。
融点の場合、物質は固体状態から液体状態に変化します。 沸点とは、液体状態から気体状態への変化を指します。
たとえば、氷の温度が0°Cに等しくなると、氷は液体の形で水に変わり始めます。 したがって、水の融点は0°C(1気圧の圧力下)です。
液体から蒸気に変えるには、水は100°Cの温度に達する必要があります。 したがって、水の沸点は100°C(1気圧の圧力下)です。

融点
固体状態の物質が受け取るとき 熱、その分子の攪拌の程度の増加があります。 その結果、その温度も上昇します。
特定の温度(融点)に達すると、分子の攪拌は、原子と分子の間の内部結合を破壊するようなものです。
この時点で、物質はその状態を変化させ始め、熱を受け続けると液体状態になります。
間に 融合 受け取った熱は状態変化のためだけに使用されるため、その温度は一定に保たれます。

相を変えるのに必要な単位質量あたりの熱は、 潜熱 融合の(Lf)そして物質の特徴です。
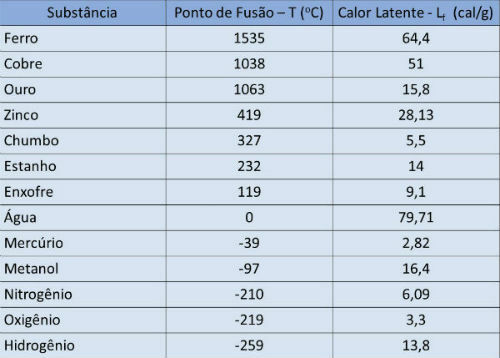
融点と潜熱表
下の表に、いくつかの物質の融点温度と潜熱を示します。 大気圧.
沸点
THE 沸騰 それは、液体から気体状態への急速な通過を特徴とし、液体内に蒸気(気泡)が形成されます。
核融合の場合と同様に、特定の物質が液体から気体の状態に変化する温度(沸点)があります。
これが発生するためには、物質は熱を受け取る必要があります。 相変化全体を通して、温度は一定に保たれます。
の潜熱 気化 (Lv)は、物質が相を変化させるのに必要な単位質量あたりの熱量です。
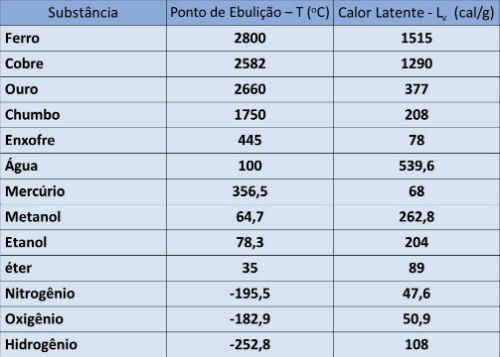
沸点と潜熱表
下の表では、大気圧でのいくつかの物質の沸点温度と蒸発潜熱を示しています。
圧力干渉
融点と沸点の温度は、物質にかかる圧力に依存します。
一般に、物質は核融合すると体積が増加します。 この事実は、圧力が高いほど、物質がその相を変えるための温度が高くなることを意味します。
例外は、水を含む一部の物質で発生し、溶融すると体積が減少します。 この場合、圧力が高くなると融点が低くなります。

圧力が下がると、特定の物質の沸点が低くなります。つまり、物質はより低い温度で沸騰します。
たとえば、海抜の高い場所では、水は100°C未満の温度で沸騰します。 その結果、これらの場所での調理には、海面の場所よりもはるかに長い時間がかかります。
あまりにも読んでください:
- 物理的状態の変化
- 温度測定スケール
- 温度測定スケール-演習
- 水の物理的状態
- 状態図
- 凝固
- 結露
- 束一性
- 周期表
- 蒸発
- 周期表の練習