溶質と溶媒は、化学溶液と呼ばれる均一な混合物の2つの成分です。
- 溶質:溶媒に分散している物質です。 これは、溶解する物質に対応し、一般に、溶液中に少量存在します。
- 溶媒:溶質が溶解して新製品を形成する物質です。 それは、溶液中に大量に現れます。
溶質(分散)と溶媒(分散剤)の間の溶解は、それらの分子間の相互作用によって発生します。
溶液のこれら2つの成分の違いは、溶質が溶解する物質であり、溶媒が溶解をもたらす物質であるということです。
最もよく知られている溶媒は水であり、 ユニバーサル溶剤. 大量の物質を溶かす能力があるからです。
溶媒と溶媒の例
化学溶液のいくつかの例を見て、それらのそれぞれの溶質と溶媒を発見してください:
水と塩
- 溶質:食卓塩-塩化ナトリウム(NaCl)
- 溶剤:水
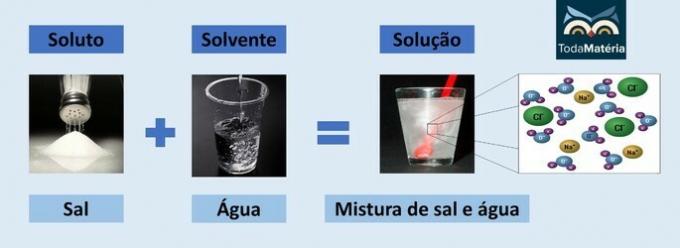
イオン性化合物であるため、溶液中の塩化ナトリウムは解離してイオンを形成し、イオンは次の分子によって溶媒和されます。 水.
水の正極(H+)塩の陰イオン(Cl-)と水の負極(O2-)陽イオン(Na+).
溶液中のイオン種は電流を流すことができるため、これは電解液の一種です。
水と砂糖
- 溶質:砂糖-ショ糖(C12H22O11)
- 溶剤:水

砂糖は共有結合性化合物であり、水に溶解すると 分子 それらは分散しますが、アイデンティティを変更しません。
この水溶液は、溶液中に分散した溶質が中性であり、したがって水と反応しないため、非電解質として分類されます。
お酢
- 溶質:酢酸(CH3COOH)
- 溶剤:水

酢は、少なくとも4%の酢酸を含む溶液です。 カルボン酸 これは極性があり、水素結合を介して水と相互作用します。
溶解度の重要なルールは、likeがlikeを溶解することです。 極性化合物は極性溶媒に溶解し、非極性物質は非極性溶媒に溶解します。
その他の解決策
液体溶液に加えて、気体および固溶体もあります。
私たちが呼吸する空気は気体溶液の例であり、そのガスの量が多いのは窒素(78%)と酸素(21%)です。
で 金属合金 それらは固溶体です。 たとえば、真ちゅう(亜鉛と銅)は楽器を作るために使用される混合物です。
もっと知識を得たいですか? だからこれらの他のテキストを読んでください:
- ケミカルソリューション
- 分子間力
- 均一および不均一混合物
溶解係数とは何ですか?
溶解係数は、飽和溶液を形成するために特定の温度で溶媒に添加される溶質の限界です。
O 溶解係数 条件によって異なり、温度や溶質の変化に応じて増減します。
溶媒が溶解を実行できる限界があります。
例:コップ一杯の水に砂糖を入れると、最初は砂糖が水に消えていることに気付くでしょう。
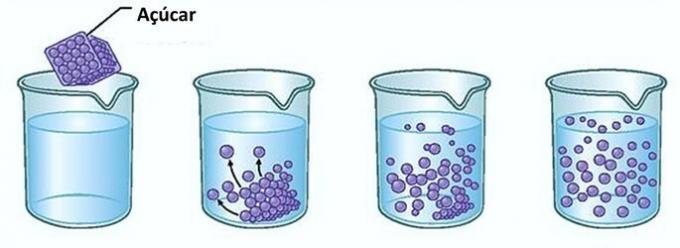
ただし、砂糖を追加し続けると、ある時点でガラスの底に砂糖が蓄積し始めることがわかります。
これは、溶媒である水が限界に達したためです。 溶解度 そして最大濃度。 容器の底に残り、溶解しない溶質はと呼ばれます 背景ボディ.
ガラスの底にある余分な砂糖は溶解せず、溶液の濃度に影響を与えません。 さらに、ガラスの底に堆積した砂糖は水を甘くしません。
ソリューションの分類
溶液は、溶解した溶質の量によって分類できます。 したがって、飽和、不飽和、過飽和の3つのタイプがあります。
- 飽和溶液:溶液が溶解係数の限界に達しました。つまり、特定の温度で溶媒に溶解する溶質の最大量があります。
- 不飽和溶液:溶質の溶解量はまだ溶解係数に達していない。 これは、より多くの溶質を追加できることを意味します。
- 過飽和溶液:通常よりも溶質が多く溶けています。 この場合、それらは沈殿物を提示します。
ソリューションの詳細については、次のテキストをお読みください。:
- 溶液の希釈
- モル濃度
- モル濃度
- 滴定
溶液の濃度
溶質と溶媒から、溶液の濃度を計算することができます。
一般的な濃度は、特定の量の溶液に溶解した溶質の質量の比率として定義されます。
濃度の計算は、次の式を使用して行われます。
であること、
Ç:濃度(g / L);
m:溶質の質量(g);
V:溶液量(L)。
例:
(Faap)400mLの溶液に30gの塩を含む硝酸ナトリウムの水溶液の濃度をg / Lで計算します。
解決:
溶質と溶媒の量に関する情報を観察します。 400mLの水溶液(溶媒)に30gの塩(溶質)が含まれています。
ただし、体積はmLであり、Lに変換する必要があります。
ここで、濃度を知るには、次の式を適用する必要があります。
この結果、30gの塩を400mLの水と混合すると、75g / Lの濃度の溶液が得られるという結論に達しました。
一般的な濃度を計算する方法の詳細については、これらのテキストが役立ちます。:
- 溶液濃度
- 一般的な濃度に関する演習

