2つの溶液が混合されている場合、それらが異なるかどうかにかかわらず、最初にそれらの間に反応があるかどうかを分析する必要があります。 たとえば、水と砂糖の溶液(ショ糖の水溶液)を水と塩の溶液(塩水)と混合すると、次のようになります。 化学反応を伴わない溶液の混合。
濃度の異なる塩化ナトリウム(NaCl)の2つの溶液を混合した場合も同じことが起こります。 この場合、反応もありません。 次に、この例を次のように定義できます。 化学反応を伴わない、同じ溶質の溶液の混合、最初の例は 化学反応を伴わない、異なる溶質の溶液の混合。
どちらの場合も、溶液の成分の化学的構成は変化しません。ただし、一部の定量的側面は再計算する必要があります。
反応なしで溶液の混合物のモル濃度(モル濃度)と一般的な濃度を決定する方法を理解するために、言及された2つのケースの解決を見てみましょう。
1番目)化学反応を起こさずに同じ溶質の溶液を混合する:

2つの塩化ナトリウム溶液を混合するとします。1つは60.0mLの溶液に2.0g / Lの濃度で、もう1つは80mLの溶液に2.5g / Lの濃度です。
反応が発生しないため、質量と体積の両方が初期の質量と体積の合計にすぎません。
m(解)= m1 (NaCl)+ m2 (NaCl)
m1 (NaCl)= v。 CM2 (NaCl)= v。 Ç
m1 (NaCl)= 0.06L。 2.0g / L m2 (NaCl)= 0.08L。 2.5g / L
m1 (NaCl)= 0.1 gm2 (NaCl)= 0.2 g
m(溶液)= 0.1 g + 0.2 g
m(溶液)= 0.3 g
v(ソリューション)= v1 (NaCl)+ v2 (NaCl)
v(溶液)=(60 + 80)mL
v(溶液)= 140 mL = 0.14 L
次に、これらのデータを使用して濃度を取得できます。
C(ソリューション)= m(解決策)
v(解決策)
C(ソリューション)= 0.3g
0.14L
C(解決策)≈ 2.14 g / L
2番目)化学反応を起こさずに、異なる溶質の溶液を混合する:
たとえば、500mlのショ糖水溶液(C12H22O11)最初は18.0 g / Lの濃度で、1 Lの塩水溶液(塩化ナトリウム-NaClの水溶液)は100.0 g / Lの濃度でした。
今やめないで... 広告の後にもっとあります;)
混合後、混合によって得られた溶液のモル濃度、一般的な濃度、質量、および体積はどのくらいでしたか?
化学反応がなかったので、Cの質量12H22O11 とNaClは変更されません。 そして、初期質量値は、反応濃度を使用して3つの単純なルールで達成できます。
18.0 g 1 L
m(C12H22O11)0.5L
m(C12H22O11)= 9.0 g
m(NaCl)100.0 g
質量は、次の式によっても達成できます。
m = v。 Ç
m(C12H22O11)= 0.5L。 18g / L
m(C12H22O11)= 9.0 g
m(NaCl)= 1L。 100.0 g / L
m(NaCl)= 100.0 g
したがって、溶液の総質量は2つの質量の合計です。
m(解)= m(C12H22O11)+ m(NaCl)
m(溶液)= 109.0 g
ボリュームは単に初期ボリュームの合計であるため、次のようになります。
v(最終解)= v(C12H22O11)+ v(NaCl)
v(最終解)=(0.5 + 1)L
v(最終解)= 1.5L
最終濃度は、各溶質の濃度を個別に計算することによって達成されます。 それらは互いに反応せず、それらの質量は変化しないため、次の濃度式を使用できます。
C = m
v
イニシャル= m初期 最終的なc = m最後の
v初期 v最後の
m初期 = m最後の
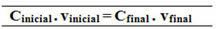
C(C12H22O11) =?
Ç初期. v初期 = C最後の. v最後の
18.0g / L。 0.5 L = C最後の .1.5 L
C(C12H22O11) 最後の = 6.0 g / L
C(NaCl)=?
Ç初期. v初期 = C最後の. v最後の
100.0g / L。 1 L = Cfinal .1.5 L
C(NaCl)最後の = 66.67 g / L
共通濃度のこの式に対して作成された関係は、モル濃度(M私. v私 = Mf. vf)および質量濃度(タイトル-T私. v私 = Tf. vf).
ジェニファー・フォガサ
化学を卒業


