電池 から来る化学エネルギーから電流が生成されるデバイスです 酸化還元反応つまり、反応物の1つの種は電子を失い(酸化)、別の種は電子を獲得します(還元)。
任意のスタックで発生する酸化および還元反応の表現を参照してください。
酸化: X→および+ X+
種Xは電子を失い、陽イオンに変わります。
削減: Y- +および→Y
Y陰イオン- 電子を獲得し、中性のY種に変化します。
スタックの基本コンポーネント
スタックの基本的なコンポーネントは次のとおりです。
アノード:酸化反応、つまり電子の損失が発生する負極。
カソード:還元反応、つまり電子獲得が行われる正極。
電解液(塩橋)または導電性材料(グラファイトバーなど):アノードから放出された電子がカソードに到達する手段です。
バッテリーの仕組みの基本
スタックの機能は、次のイベントから発生します。
第一原理: アノード酸化
アノードの金属は、電子を失う傾向が大きいため、次の式で観察されるように、陽イオンになります。
Zn→Zn2+ +2および
第2の原則: カソード還元
陰極に存在する材料の一部である陽イオン(例として銅を使用します)を受け取るとき 方程式でわかるように、アノードからの電子は金属銅に変換されます ベローズ:
お尻2+ + 2e→Cu
最初の山
a)アレッサンドロボルタのバッテリー
1800年に組み立てられたアレッサンドロのパイルバック(歴史上最初のパイル)は、下の画像のように、挿入された金属ディスクによって形成されました。

アレッサンドロの「あなたの山に戻る」に似た組み立て
ディスクは組成が異なるため、インターリーブされました。 1つは亜鉛金属でできていて、もう1つは銅でできていて、常に塩水(水と塩で形成された溶液)に浸した綿で区切られていました。
B) ダニエルの山
1836年に組み立てられたダニエルの山は、導線と塩橋で接続された2つの半電池で構成されていました。
半電池1:それはアノード、つまりバッテリーの負極でした。
それは亜鉛板で構成されており、この板の一部は水と硫酸亜鉛(ZnSO)によって形成された溶液に沈められました。4).
半電池2: それは陰極、つまりバッテリーの正極でした。
銅板で構成されており、この板の一部を水と硫酸銅(CuSO)の溶液に浸しました。4).
塩橋
水と塩化カリウム(KCl)で形成された溶液を含み、2つの半電池(亜鉛と銅)を接続し、両端にグラスウールを備えたU字型のチューブ。
現在のバッテリー
現在、スタックにはいくつかのモデルがありますが、一般的には次のようになります。
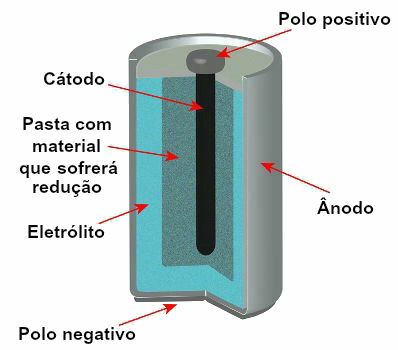
現在のスタックのモデルを表す概略図
最も使用されているモデルは、いわゆるルクランシェ電池とアルカリ電池です。これらには次の違いがあります。
) ルクランシェパイル
それは金属亜鉛によって形成された陽極を持っています。
塩化アンモニウム、水、でんぷん、二酸化マンガンのペーストで形成された陰極を持っています。
それは、陰極から陽極に向かって出発する電子の導体として機能するグラファイトバーを持っています。
B) アルカリ電池
金属亜鉛またはカドミウムで形成されたアノードがあります。
酸化水銀、酸化ニッケル、ヨウ素で形成された陰極を持っています。
カソードを構成する材料に混合ベースが含まれている必要があります。
私によって。DiogoLopesDias
ソース: ブラジルの学校- https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-pilha.htm

