スポーツ活動、病院、そして私たちの日常生活では、ホットとコールドのインスタント湿布の使用が非常に一般的です。 どちらの場合も、特定の物質は水と反応します。 たとえば、冷湿布の場合、NHから水を分離する2つのカプセルが含まれています4で3、水に溶けると熱を吸収し、瞬時に冷えます。 温湿布の場合、CaClは水に溶解します2 またはMgSO4、エネルギーを放出して熱を発生させます。
だが 特定のソリューションが発熱し、発熱する理由。 と他の人は吸熱して、吸収しますか?
さて、この問題を理解するには、 溶液のエンタルピー変動(ΔH)、これは2つのステップで構成されています。
(1回目)網状エンタルピー(ΔHret): 溶質が水に溶解するとき、最初のステップは、結晶格子内にあるそのイオンを分離することです。 イオン間の結合を切断するには、システムにエネルギーを供給する必要があります。 したがって、この最初のプロセスは 吸熱、エネルギーを吸収するので; あなたのものであること 正のエンタルピー(ΔH> 0)。

(2番目)水和エンタルピー(ΔH隠した): イオンが分離した後、それらは溶媒分子に包まれます。 水の場合は溶剤であり、水和が起こっていると言えます。 水の双極子は、それぞれ反対に帯電したイオンに引き付けられます。 したがって、この相互作用が起こるためには、エネルギーの放出が必要です。 したがって、水分補給において エンタルピーは負になります(ΔH<0)、プロセスは 発熱.
今やめないで... 広告の後にもっとあります;)
次の図は、イオンと双極子の相互作用、つまり、分離されたイオンの電荷と水双極子の間の引力がある水和がどのように発生するかを示しています。

溶液のエンタルピー変化(ΔH太陽)は、これら2つのエンタルピーの合計によって決定されます。 結果が正の場合、網状エンタルピーが高いことを意味します。したがって、溶解エンタルピーは、プロセスが吸熱性であることを示します。
吸熱溶解のエンタルピー図を以下に示します。

これは、以下に示すヨウ化カリウムの溶解の場合によって示されます。

エンタルピー図は次のように表されます。

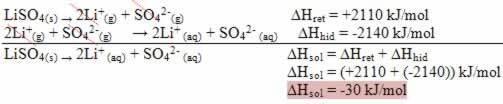
結果が正の場合、水和のエンタルピーは網状のものよりも大きくなり、プロセスは発熱します。 発熱溶解のエンタルピー図は、次の例に示すように表されます。


以下のエンタルピー図に注意してください。

ジェニファー・フォガサ
化学を卒業
学校や学業でこのテキストを参照しますか? 見てください:
FOGAÇA、ジェニファー・ロシャ・バルガス。 "ソリューションエンタルピー変動"; ブラジルの学校. で利用可能: https://brasilescola.uol.com.br/quimica/variacao-entalpia-solucao.htm. 2021年6月28日にアクセス。