או איזון משוואת הפחתת חמצון זה מבוסס על השוויון של מספר האלקטרונים הניתנים למספר האלקטרונים שהתקבלו. שיטה פשוטה לביצוע איזון זה ניתנת על ידי השלבים הבאים:
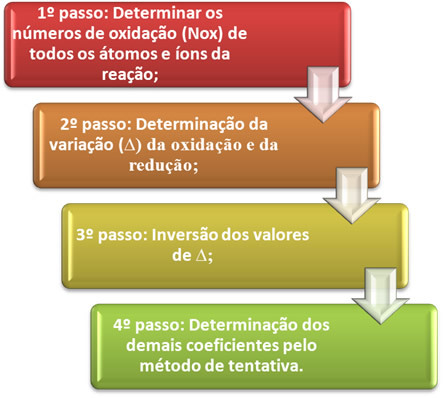
בואו נראה בפועל כיצד ליישם את השלבים הללו, באמצעות הדוגמה הבאה:
תגובה בין תמיסה מימית של אשלגן פרמנגנט וחומצה הידרוכלורית:
kmnO4 + HCl → KCl + MnCl2 + קל2 + H2או
*שלב 1:קבע מספרים של חמצון:
שלב זה חשוב מכיוון שלרוב איננו יכולים לדמיין במהירות אילו מינים עוברים חמצון והפחתה.
+1 +7 -2 +1 -1 +1 -1 +2 -1 0 +1 -2
kmnO4 + HCl → KCl + MnCl2 + קל2 + H2או
*שלב שני:קביעת וריאציה של חמצון והפחתה:

שים לב שמנגן (Mn) מופחת וכלור (Cl) מחומצן.
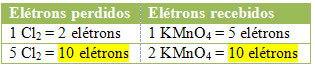
MnCl2 = ∆ Nox = 5
קל2 = ∆ לא = 2
במקרה של כלור, אנו יכולים לציין כי HCl הוליד 3 תרכובות (KCl, MnCl2, וקל2), אך מה שמעניין אותנו הוא ה- Cl2, כי זה ה- Nox שלך שסבל משונות. כל כלור היוצר Cl2 לאבד אלקטרון אחד; מכיוון שנדרש 2 כלור ליצירת כל Cl2ואז שני אלקטרונים הולכים לאיבוד.
שלב שלישי:היפוך של ערכי ∆:
בשלב זה ערכי ∆ מוחלפים בין המינים שהוזכרו והופכים למקדמיהם:
MnCl2 = ∆ לא = 5 → 5 יהיה המקדם של Cl2
קל2 = ∆ לא = 2→ 2 יהיה המקדם של MnCl2
kmnO4 + HCl → KCl + 2 MnCl2 + 5 קל2 + H2או
בשלב זה כבר ניתן לדעת שני מקדמים של המשוואה.
תַצְפִּית: בדרך כלל, ברוב התגובות, היפוך ערכים זה מבוצע על החבר הראשון. אך, ככלל, יש לעשות זאת אצל החבר בעל המספר הגדול ביותר של אטומים העוברים חידוש. אם לא ניתן לעמוד בקריטריון זה, אנו הופכים את הערכים עבור החבר בעל המספר הכימי הגבוה ביותר. זה מה שנעשה כאן, שכן לחבר השני יש יותר חומרים.
שלב רביעי: איזון משפט:
kmnO4 + HCl → KCl + 2 MnCl2 + 5 קל2 + H2או
- מכיוון שבחבר השני ישנם שני אטומי מנגן, כפי שמוצג על ידי המקדם, בראשון חייב להיות גם. אז יש לנו:
2 kmnO4 + HCl → KCl + 2 MnCl2 + 5 קל2 + H2או
- לפיכך, כמות האשלגן (K) בחבר הראשון הייתה 2, שיהיה אותו מקדם לאטום זה בחבר השני:
2 קמ"נ4 + HCl → 2 KCl + 2 MnCl2 + 5 קל2 + H2או
- כמות הכלור (Cl) בחבר השני היא 16 בסך הכל, כך שמקדם ה- HCl של החבר הראשון יהיה:
2 קמ"נ4 + 16 HCl → 2 KCl + 2 MnCl2 + 5 קל2 + H2או
- מספר המימנים בחבר הראשון הוא 16 ומכאן מקדם המים (H2O) של החבר השני יהיה שווה ל- 8, מכיוון שכפל מדד המימן (2) ב- 8 שווה ל- 16:
2 קמ"נ4 + 16 HCl → 2 KCl + 2 MnCl2 + 5 קל2 + 8 ה2או
- כדי לבדוק אם המשוואה מאוזנת כראוי נוכל לראות שני קריטריונים:
1) בדוק אם כמות כל אטום בשני האיברים שווה:
2 קמ"נ4 + 16 HCl →2 KCl + 2 MnCl2 + 5 קל2 + 8 ח2או
K = 2K = 2
Mn = 2 Mn = 2
Cl = 16 Cl = 16
H = 16 H = 16
O = 8 O = 8
2) בדוק אם המספר הכולל של האלקטרונים שאבדו שווה למספר הכולל של האלקטרונים שהתקבלו:
מאת ג'ניפר פוגאצה
בוגר כימיה
מָקוֹר: בית ספר ברזיל - https://brasilescola.uol.com.br/quimica/balanceamento-por-oxirreducao.htm
