תרכובות מסוימות אינן צריכות להחזיק שמונה אלקטרונים במעטפת הערכיות כדי להשיג יציבות, ולכן הם נחשבים לחריגים מכלל האוקטט. למד עכשיו מדוע יש אלמנטים הנמלטים מהחובה שיש אוקטט של אלקטרונים בקליפה האחרונה.
בריליום (לִהיוֹת)
זה חריג לכלל אוקטט מכיוון שהוא מסוגל ליצור תרכובות עם שני קשרים בודדים, ולכן הוא מתייצב עם ארבעה אלקטרונים בלבד בקליפת הערכיות. 
מכיוון שמימן (H) צריך לוותר על שני אלקטרונים כדי ליצור את הקשר (H - ובכן - H), אטום הבריליום (Be) חולק את האלקטרונים שלו ומשיג יציבות.
אֲלוּמִינְיוּם (אל)
זה חריג לכלל אוקטט מכיוון שהוא משיג יציבות עם שישה אלקטרונים בקליפת הערכיות. אטום האלומיניום נוטה לתרום את האלקטרונים שלו וכך יכול ליצור שלושה קשרים בודדים עם אטומים אחרים: 
במקרה זה, אלומיניום (Al) יצר שלושה קשרים עם שלושה אטומי פלואור (F).
בּוֹר (ב)
הוא יוצר חומרים מולקולריים עם שלושה קשרים בודדים. 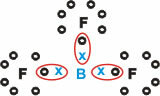
שים לב כי בורון (B) נוטה לתרום את האלקטרונים שלו לאטומי פלואור (F), המצייתים לכלל האוקטט, הדורש שמונה אלקטרונים במעטפת הערכיות. כאשר בורון מוותר על האלקטרונים שלו, הפלואור מתייצב עם האוקטטה שנוצרת.
מאת ליריה אלבס
בוגר כימיה
צוות בית הספר בברזיל
ראה עוד!
תורת האוקטט
כימיה כללית - כִּימִיָה - בית ספר ברזיל
מָקוֹר: בית ספר ברזיל - https://brasilescola.uol.com.br/quimica/excecoes-regra-octeto.htm

