ה פסטהאָטוֹמִי, כפי ששמו מרמז, זוהי המסה של אטום, מסומלת בדרך כלל על ידי "mה" או "MA". עם זאת, מכיוון שהאטום הוא ישות קטנה ביותר, בלתי נראית לעיני האדם, לא ניתן למדוד את המסה שלו באמצעות קשקשים, למשל. אז מדענים קבעו את מסת האטומים על ידי השוואתם למסה של אטומים אחרים.
זה נעשה גם עם היחידות האחרות. לדוגמה, יחידת המסה היא הקילוגרם הסטנדרטי, המקביל לגליל בגובה ובקוטר של 3.917 ס"מ, העשוי מ-10% אירידיום ו-90% פלטינה. אז זה משמש כהשוואה. לדוגמה, אם "נשקל" חפץ על סולם ונגלה שהמסה שלו היא 10 ק"ג, זה אומר שהמסה שלו גדולה פי 10 מהתקן הנבחר: 1 ק"ג.
כך גם לגבי אטומים. התקן שנבחר היה פחמן-12, ולאטום זה הוקצתה באופן שרירותי מסה של 12 u. ה-"u" הוא יחידת המסה האטומית ולכן שווה ערך ל-1/12 מסה של אטום פחמן.
לדוגמה, כאשר אנו אומרים שהמסה האטומית של מימן שווה ל-1 u, זה אומר שזה כאילו אם נחלק את הפחמן ל-12 חלקים, המסה של אחד מהחלקים האלה שווה למסה של האטום של מֵימָן. דוגמה נוספת היא גופרית, המסה האטומית שלו היא 32 u, כלומר המסה שלו גדולה פי 32 מ-1/12 מהמסה של 12Ç.
1 u = 1/12 מהמסה של 1 אטום פחמן 12

יחידת המסה האטומית היא 1/12 מהמסה של פחמן-12
המסה המולקולרית של חומרים היא סכום המסות האטומיות של היסודות. לדוגמה, המסה האטומית של חמצן שווה ל-16 u, כך שהמסה המולקולרית של מולקולת גז החמצן (O2) שווה ל-32u.
מכיוון שטכניקות מעבדה מתקדמות מאוד כיום, ישנם מכשירים המודדים במדויק את המסה האטומית של יסודות, כמו ספקטרומטר המסה. לפיכך, אפשר לדעת זאת 1 u שווה ל-1.66054. 10-24 ז.
מפת חשיבה: מסה אטומית

*להורדת מפת החשיבה ב-PDF, לחץ כאן!
מכיוון שמסות אטומיות נקבעות בדיוק רב, הן ניתנות בטבלה המחזורית בצורה של מספרים עשרוניים. אבל כשאנחנו הולכים לעשות את החישובים, אנחנו בדרך כלל משתמשים במספר המעוגל, למעט ניסויים שצריכים להיות מאוד מדויקים. לדוגמה, אם תסתכל על הטבלה המחזורית, תראה שהמסה האטומית של חמצן שווה ל-15,999 u, אבל בדרך כלל אנו משתמשים בערך 16 u בחישובים. זה קורה גם עם פחמן, שהמסה האטומית שלו נתונה על ידי 12.01 u, כפי שמוצג להלן:
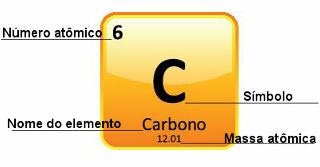
ייצוג פחמן בטבלה המחזורית
היסודות המופיעים בטבלה המחזורית הם למעשה הממוצע המשוקלל של כל האיזוטופים הטבעיים של היסוד. לפיכך, המסה האטומית המופיעה בטבלה היא גם הממוצע של המסות האטומיות של יסודות אלה. לדוגמה, לכלור (C?) יש שני איזוטופים טבעיים, 35 ו-37, שהאחוזים שלהם בטבע הם 75.76% ו-24.24%. המסות האטומיות של כל אחד מהאיזוטופים הללו שונים, כאשר זו של C?-35 היא 34.96885 u וזו של C?-37 היא 36.96590.
באופן זה, המסה האטומית של היסוד מחושבת תוך התחשבות במסה של כל איזוטופ ובשפע שבו הוא מופיע בטבע. במקרה של כלור, יש לנו:
המסה האטומית של היסוד כלור = (34,96885. 75,76%) + (36,96590. 24,24%)
100%
המסה האטומית של היסוד כלור = 35.45
זהו ערך המסה האטומית של הכלור המופיע בטבלה המחזורית.
* מפת חשיבה מאת אותי דיוגו לופס
מאת ג'ניפר פוגאסה
בוגר מכתבים
מָקוֹר: בית ספר ברזיל - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-massa-atomica.htm
