קינטיקה כימית חוקרת את מהירות התגובות הכימיות ואת הגורמים המשפיעים על קצב התגובות הללו.
השתמש בשאלות שלמטה כדי לבדוק את הידע שלך ולבדוק את ההערות על ההחלטות.
שאלה 1
לגבי הגורמים המשפיעים על מהירות התגובה הכימית, לא נכון לציין כי:
א) ככל שריכוז המגיבים גבוה יותר, התגובה מהירה יותר.
ב) ככל שמשטח המגע גדול יותר, כך מהירות התגובה גדולה יותר.
ג) ככל שהלחץ גבוה יותר, התגובה מהירה יותר.
ד) ככל שהטמפרטורה גבוהה יותר, התגובה מהירה יותר.
ה) נוכחות זרז שומרת על קצב התגובה קבוע.
חלופה לא נכונה: ה) נוכחות של זרז שומרת על קצב התגובה קבוע.
זרזים מגבירים את מהירות התגובה, מכיוון שהם מקלים על היווצרות הקומפלקס המופעל בין המגיבים.
עם זאת, הזרזים יוצרים מנגנון קצר יותר להתפתחות התגובה, מה שגורם למהירות לעלות.
שאלה 2
על פי _____________ חייבים להתרחש התנגשויות יעילות בין ריאגנטים ליצירת המוצרים. בנוסף, יש מספיק ___________ לשבור את הקשרים הכימיים של המגיבים וליצור ___________, שהוא מצב ביניים לפני היווצרותם של מוצרים.
המילים הממלאות כראוי את החסר הן, בהתאמה:
א) אנתלפיה, אנרגיה קינטית וריאציה של זרז.
ב) תורת התנגשות, אנרגיית הפעלה ומכלול מופעל.
ג) מהירות תגובה, אנטלפיה ומעכב.
ד) לחץ חלקי, אנטרופיה ומצע.
חלופה נכונה: ב) תורת התנגשות, אנרגיית הפעלה ותסביך מופעל.
על פי תורת ההתנגשות, ההתנגשויות בין המגיבים נחוצות כדי שתתרחש תגובה כימית. לשם כך, החומרים חייבים להיות במצב חיובי כדי שהזעזועים יהיו יעילים.
אנרגיית הפעלה משמשת כמחסום אנרגיה שיש להתגבר עליו כדי לשבור את הקשרים של תרכובות מגיבות. ככל שאנרגיית ההפעלה נמוכה יותר, התגובה מהירה יותר.
המתחם המופעל הוא זן ביניים לא יציב שנוצר לפני התוצרים.
שאלה 3
ארבע ההצהרות הבאות מושמעות לגבי זרזים:
אני. זרז פועל על ידי הגדלת מהירות התגובה, אך אינו משנה את ביצועיה.
II. בתגובה כימית הזרז אינו נצרך בנתיב התגובה.
III. זרזים יוצרים דרך חלופית להפיכת מגיבים למוצרים. לשם כך יש צורך באנרגיית הפעלה גדולה יותר.
IV. הזרז מסוגל להאיץ רק את התגובה בכיוון קדימה.
האפשרויות המציגות מידע נכון לגבי זרזים הן:
א) I ו- II
ב) II ו- III
ג) אני ו- IV
ד) הכל
חלופה נכונה: א) I ו- II.
זרזים משמשים לזרז תגובות כימיות. התגובה באמצעות הזרז אינה משנה את תפוקתו, כלומר הכמות הצפויה של המוצר מיוצרת, אך תוך פחות זמן.
זרזים אינם נצרכים במהלך התגובה הכימית, הם מסייעים ביצירת המתחם המופעל. לכן, ניתן להחזיר זרז בסוף התגובה הכימית.
זרזים מסוגלים להפחית את זמן התגובה על ידי יצירת מנגנון חלופי ליצירת מוצרים בעלי אנרגיית הפעלה נמוכה יותר. לכן, התגובה מתרחשת מהר יותר.
זרזים פועלים הן בכיוון הקדמי והן בכיוון ההפוך של התגובה.
שאלה 4
כמה מהר מתרחשת תגובה כימית תלוי ב:
אני. מספר התנגשויות יעילות בין ריאגנטים.
II. מספיק אנרגיה כדי לסדר מחדש את האטומים.
III. אוריינטציה חיובית של מולקולות.
IV. היווצרות מתחם מופעל.
א) I ו- II
ב) II ו- IV
ג) I, II ו- III
ד) I, II, III ו- IV
חלופה נכונה: ד) I, II, III ו- IV.
התנגשויות אפקטיביות מתרחשות כאשר המגיבים נמצאים בעמדות חיוביות לזעזועים, מה שיקדם את סידורם מחדש של האטומים.
אנרגיית ההפעלה חייבת להספיק כדי שההתנגשות בין המגיבים תביא לשבירת קשרים וליצירת המתחם המופעל.
לא כל התנגשויות בין חלקיקים מגיבים גורמות לתגובה להתרחש. האוריינטציה בה מתרחשת ההתנגשות חשובה להיווצרות המוצרים.
המתחם המופעל הוא מצב ביניים ולא יציב לפני היווצרות מוצרים. הוא נוצר כאשר חורגת מאנרגיית ההפעלה לתגובה.
שאלה 5
פחמן דו חמצני הוא גז שנוצר על ידי התגובה בין פחמן חד חמצני לגזי חמצן, על פי המשוואה הכימית להלן.
שיתוף(ז) + ½ ה2 (גרם) → CO2 (גרם)
בידיעה שבתוך 5 דקות של תגובה נצרכו 2.5 mol CO, מהו קצב התפתחות התגובה על פי צריכת O2?
א) 0.2 מול. דקה-1
ב) 1.5 מול. דקה-1
ג) 2.0 מול. דקה-1
ד) 0.25 מול. דקה-1
חלופה נכונה: ד) 0.25 מול. דקה-1
כדי לענות על שאלה זו עלינו לבחון את המשוואה הכימית.
שיתוף(ז) + ½ ה2 (גרם) → CO2 (גרם)
שים לב ששומה אחת של פחמן חד-חמצני מגיבה עם חצי מול של חמצן ליצירת 1 מול של פחמן דו חמצני.
הכמות שניתנה בהצהרה מתייחסת לפחמן חד חמצני, אך התשובה חייבת להיות מבחינת חמצן. לשם כך עלינו לבצע כלל של שלוש ולמצוא את כמות החמצן.
1 mol CO - ½ mol O2
2.5 mol CO - x של O2
x = 1.25 מול
כעת אנו מיישמים את הערכים בנוסחה לקצב התפתחות התגובה.
לכן, קצב התפתחות התגובה ביחס לחמצן הוא 0.25 mol.min-1.
שאלה 6
שימו לב לייצוג הגרפי של התפתחות תגובה כימית היפותטית, המתייחסת לאנרגיה ולדרך התגובה.
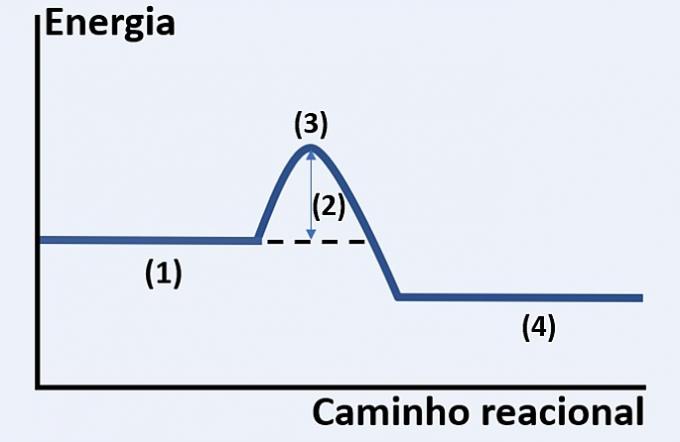
בדוק את החלופה המחליפה כראוי את (1), (2), (3) ו- (4), בהתאמה.
א) מצעים, חום משוחרר, מצב אנרגיה מרבי וסוף תגובה.
ב) ריאגנטים, אנרגיית הפעלה, קומפלקס מופעל ומוצרים.
ג) מגיבים, אנרגיה קינטית, זרז ומצעים.
ד) מגיבים, חום נספג, אנרגיה תרמית ומוצרים.
חלופה נכונה: ב) ריאגנטים, אנרגיית הפעלה, קומפלקס מופעל ומוצרים.
הגרף המוצג הוא של תגובה אנדותרמית, כלומר, יש ספיגת אנרגיה להתרחשות התגובה.
אתה ריאגנטים (1) נמצאים בתחילת הגרף וה- אנרגיית הפעלה (2) תואם את ההפרש בין האנרגיה המאוחסנת בתגובות לבין מורכב מופעל (3). לבסוף, לאחר שעבר את מצב הביניים, היווצרות מוצרים (4).
לכן, המגיבים צריכים להתגבר על אנרגיית ההפעלה כדי לסדר מחדש את האטומים שלהם למבנה ביניים הנקרא קומפלקס מופעל על מנת שהמוצרים ייווצרו.
שאלה 7
חומר A מסוגל להתפרק ולהפוך לחומר B. התבונן בהתפתחות התגובה הזו בתמונה למטה.

לגבי מהירות התגובה, אנו יכולים לומר כי:
א) חומר A מתפרק בין 0 ל -15 שניות בקצב של 0.35 מול-1.
ב) חומר A מתפרק בין 15 ל- 30 שניות בקצב של 0.02 מול '-1.
ג) חומר A מתפרק בין 0 ל -15 שניות בקצב של 0.04 מול '-1.
ד) חומר A מתפרק בין 15 ל 30 שניות בקצב של 0.03 מול-1.
חלופה נכונה: ד) חומר A מתפרק בין 15 ל -30 שניות בקצב של 0.03 מול.ס -1.
ניתן לחשב את קצב הפירוק של חומר A לפי הנוסחה:
בואו נחשב את מהירות התגובה במונחים של חומר A בין המרווחים הנתונים.
טווח בין 0 ל -15:
טווח בין 15 ל -30:
לכן, חלופה d נכונה, מכיוון שחומר A מתפרק בין 15 ל -30 שניות בקצב של 0.03 מול '.-1.
שאלה 8
שקול את התגובה ההיפותטית הבאה.
aA + bB → cC + dD
שים לב לשינוי בריכוז A ו- C להלן.
| פִּי) | 0 | 5 | 10 | 15 | 20 | 25 |
|---|---|---|---|---|---|---|
| צריכת A (mol / L) | 7,5 | 6,0 | 4,5 | 3,0 | 2,5 | 1,0 |
| היווצרות C (mol / L) | 0 | 0,5 | 1,0 | 1,5 | 2,0 | 2,5 |
בהתבסס על המידע שנמסר בשאלה, מה בהתאמה קצב צריכת A וקצב היווצרות C במרווח שבין 5 ל 25 דקות?
א) 0.3 מול. ל-1.s-1 ו 0.1 mol. ל-1.s-1
ב) - 0.1 מול. ל-1.s-1 ו- 0.3 מול. ל-1.s-1
ג) - 0.25 מול. ל-1.s-1 ו 0.1 mol. ל-1.s-1
ד) 0.1 מול. ל-1.s-1 ו- 0.3 מול. ל-1.s-1
חלופה נכונה: ג) - 0.25 מול. ל-1.s-1 ו 0.1 mol. ל-1.s-1.
שיעור צריכה:
שיעור אימונים C:
לכן, בתגובה, A נצרך בקצב של 0.25 mol.s-1, כך שערכו שלילי, בעוד B נוצר בקצב של 0.1 mol. ל-1.s-1.
קרא גם:
- קינטיקה כימית
- תרמו-כימיה
- איזון כימי
- תגובה כימית


