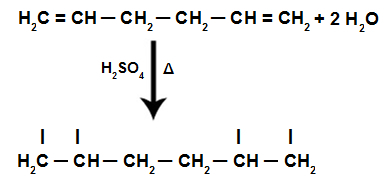
או תַחשִׁיב סטואיכיומטרית הוא נושא חוזר מאוד בכל המהדורות של Enem והוא קיים באופן ישיר או עקיף בכמה תכנים אחרים בכימיה, כגון:
פתרונות
תרמו-כימיה
קינטיקה כימית
איזון כימי
אלקטרוכימיה
רדיואקטיבי
חקר גזים
פונקציות אורגניות
בטקסט זה תהיה לך גישה לעצות חשובות מאוד לפתרון חישובים סטויכיומטריים פשוטים ב- Enem:
טיפ ראשון: ידע בסיסי לפיתוח חישוב סטואיכומטרי
חוק לבואזיה: סכום המוני המגיבים שווה לסכום המוני המוצרים.
A + B → C + D
mA + mB = mC + mD
חוק פרוסט: הפרופורציה ההמונית של כל אחד מהמשתתפים בתגובה היא תמיד זהה.
A + B → C + D
רַע + MB = mC + MD
mA 'mB' mC 'mD'
מול (כמות חומר): לפי אבוגדרו, בשומה אחת, תמיד יש לנו 6.02.1023 ישויות (מולקולות, אטומים, יונים וכו ').
1mol6.02. 1023
חישוב המסה הטוחנת: המסה הטוחנת המחושבת על ידי נוסחת החומר (XaYb), היא סכום התוצאות של הכפלת הכמות של כל יסוד כימי במסה האטומית שלו.
מסה טוחנת = א.מסה של X (בטבלה המחזורית) + ב.מסה של Y (בטבלה המחזורית)
מסה מולארית: שווה ערך למסה בגרמים המקבילה ל- 6.02.1023 ישויות חומר.
1mol6.02. 1023מסה בגרם (טוחנת)
נפח טוחן: שווה ערך ל 22.4 ליטר, המתייחסים לשטח שנכבש בתאריך 6.02.1023 ישויות חומר:
1mol6.02. 1023מסה בגרמים (טוחנת) 22.4L
איזון משוואות כימיות: מקדמים ההופכים את מספר האטומים של כל היסודות הכימיים לשווה בתגובות ובמוצרים.
טיפ שני: צעדים בסיסיים לפתרון חישוב סטויוכיומטרי
הסר את הנתונים שמספק התרגיל;
כתוב את המשוואה הכימית אם התרגיל לא סיפק אותה;
איזון המשוואה;
יש להשתמש במקדמים המשמשים לאיזון בכדי לדעת את הפרופורציות הסטואיכומטריות בין המשתתפים;
בנה כללים של שלושה המתייחסים למידע הקיים בהצהרה, אלמנטים של המשוואה והאיזון שלה.
טיפ שלישי: יחסים בסיסיים בחישוב סטויוכומטרי
בכל כלל משלושה המורכב בתרגיל חישוב סטויכיומטרי, אנו יכולים ליצור את היחסים הבאים
נפח ————————- mol
אוֹ
נפח ————————-- נפח
אוֹ
מיסה —————————— שומות
אוֹ
מיסה ————————— מיסה
אוֹ
מסה ——————————- מספר ישויות
אוֹ
mol ——————————- מספר ישויות
אוֹ
נפח ——————————- מספר ישויות
אוֹ
נפח ————————— מסה
טיפ 4: כיצד להמשיך בתרגיל הכרוך בתגובות עוקבות
תגובות עוקבות הן שלבי תגובה היוצרים תגובה אחת. כאשר הם חלק מהתרגיל, עלינו, לפני ביצוע החישוב הסטואיכיומטרי, ליצור תגובה אחת.
לשם כך עלינו לבטל את החומר המופיע במגיב של אחד ובמוצר של השני. לדוגמה:
S + O2 → מערכת הפעלה2
רק2 + O2 → מערכת הפעלה3
רק3 + H2O → H2רק4
ביטול מערכת ההפעלה2 ומערכת ההפעלה3, יש לנו את התגובה הבאה:
S + 3 / 2O2 + H2או → H2רק4
טיפ חמישי: כיצד להמשיך בתרגיל שכולל ריאגנט ב עודף ומגביל
אנו יודעים שתרגיל כרוך בעודף ומגביל בכל פעם בהצהרה יש לנו את המסה של שני החומרים המרכיבים את המגיבים. כדי לפתח חישובים סטויוכיומטריים, עלינו להשתמש תמיד במסה המאוגדת.
כדי לגלות את המסה של הכור המגביל, פשוט חלק את המסה הטוחנת של כל חומר, מוכפל במקדם הסטואיכיומטרי שלו במשוואה, ומחולק במסה הניתנת על ידי תרגיל.
לדוגמא, אם יש לנו תגובה כימית של 50 גרם NaCl עם 50 גרם CaBr2:
2 NaCl + 1 CaBr2 → 2 NaBr + 1 CaCl2
2.58,5 = 1. 200
50 50
2,34 = 4
הערך הגדול ביותר של חלוקה זו תמיד תואם את הגיב עודף, ואילו הערך הקטן ביותר תמיד תואם את המגיב המגביל.
טיפ 6: כיצד להמשיך בתרגיל הכרוך בטוהר
בתרגילי חישוב סטויוכיומטריים הכוללים טוהר או טומאה יש באמירה את האחוז המתייחס לחלק הטהור או הטמא של המדגם. אז קודם כל, עלינו לחשב מהי המסה הטהורה באמת של המדגם, מכיוון שהוא לבדו מוליד תוצר של תגובה.
לדוגמא, אם יש לנו 70 גרם של דגימה ו -20% ממנה טהורים, אז 80% ממנה טהורים. אז קבענו כלל של שלוש כדי לקבוע את המסה בגרם טהור:
70 גרם 100%
xg80%
100.x = 70.80
100x = 5600
x = 5600
100
x = 56 גרם בצק טהור.
טיפ 7: כיצד להמשיך בתרגיל שכרוך בו תְשׁוּאָה
אל תפסיק עכשיו... יש עוד אחרי הפרסום;)
התשואה קשורה לכמות בפועל, בגרמים, של מוצר שנוצר ממסה מסוימת של מגיב. התרגיל אומר לנו בדרך כלל כמה מסה נוצרה. לאחר מכן עלינו לחשב את המסה של המוצר עם מסת הריאגנט המסופק ולשחק את כלל השלושה להלן:
מסת מוצר מחושבת 100%
מסת מוצר x%
המסופק על ידי
תרגיל
לדוגמא, בתגובה של 40 גרם פחמן עם חמצן נוצרו 15 גרם פחמן דו חמצני. מה תניב התגובה?
1 C + 1 O2 → 1 CO2
1.12 גרם פחמן 1.44 גרם CO2
40 גרם פחמן
12.x = 40.44
12x = 1760
x = 1760
12
x = 146.6 גרם CO2
ואז אנו קובעים את התשואה:
146.6 גרם 100%
15gx%
146.6x = 1500
x = 1500
146,6
x = 10.2%
עקוב אחר ההחלטה של שתי דוגמאות:
דוגמה 1: (אויב) נכון להיום, מערכות טיהור פליטה מזהמות נדרשות על פי החוק במספר גדל והולך של מדינות. שליטה על פליטת גופרית דו-חמצנית גזית משריפת פחם, המכילה גופרית, יכולה להיות נוצר על ידי התגובה של גז זה עם מתלה של סידן הידרוקסיד במים, ויוצר מוצר שאינו מזהם את ה אוויר. שריפת הגופרית ותגובת הגופרית הדו-חמצנית עם סידן הידרוקסיד, כמו גם המוני חלק מהחומרים המעורבים בתגובות אלה, ניתן לייצג באופן הבא:
גופרית (32 גרם) + חמצן (32 גרם) → דו תחמוצת הגופרית (64 גרם)
דו תחמוצת הגופרית (64 גרם) + סידן הידרוקסיד (74 גרם) → מוצר שאינו מזהם
בדרך זו, לספוג את כל הגופרית הדו-חמצנית המיוצרת על ידי שריפת טון פחם (המכיל 1% גופרית), מספיק להשתמש במסת סידן הידרוקסיד של על אודות:
א) 23 ק"ג.
ב) 43 ק"ג.
ג) 64 ק"ג.
ד) 74 ק"ג.
ה) 138 ק"ג.
פתרון הבעיה:
הנתונים שנמסרו על ידי התרגיל:
1 טון פחם (C)
בפחם יש לנו 1% גופרית (טוהר)
מה המסה של סידן הידרוקסיד?
1או שלב: בנה משוואה רק מהתגובות העוקבות המסופקות:
S + O2 → מערכת הפעלה2
רק2 + Ca (OH)2 → CaCO3 + H2ס
חיתוך מה שחוזר על עצמו, יש לנו את התגובה הבאה:
S + 1 / 2O2+ Ca (OH)2 → CaCO3 +ה2ס
הערה: ניתן להזניח שלב זה, מכיוון שהתרגיל כולל רק גופרית וסידן הידרוקסיד
2או שלב: חשב את מסת הגופרית הקיימת בטון אחד של פחם, וזכור כי 1% הוא גופרית, ואז:
1t של 100% פחם
גופרית 1%
100x = 1
x = 1
100
x = 0.01 ט או 10 ק"ג גופרית
3או שלב: מתוך מסת הגופרית נוכל לחשב את מסת הסידן ההידרוקסיד. בחישוב סטויוכיומטרי זה, נמנה רק מסות:
S Ca (OH)2
1.32 גרם 1.74 גרם
10 ק"ג
32.x = 74.10
x = 740
32
x = 23.125 ק"ג גז בוטאן
דוגמה 2: (אויב) ביפן, תנועה לאומית לקידום המאבק בהתחממות כדור הארץ נושאת את הסיסמה: אדם אחד, יום אחד, 1 ק"ג CO2 אוהב אותנו! הרעיון הוא שכל אדם יפחית את כמות ה- CO ב -1 ק"ג2 מוציאים מדי יום, באמצעות מחוות אקולוגיות קטנות, כמו הפחתת שריפת גז בישול. המבורגר אקולוגי? ובינתיים! אפשר להשיג ב: http://lqes.iqm.unicamp.br. גישה בתאריך: 24 בפברואר 2012 (מותאם).
בהתחשב בתהליך בעירה מלא של גז בישול המורכב אך ורק מבוטאן (ג4ה10), הכמות המינימלית של הגז הזה שעל יפני להפסיק לשרוף כדי לעמוד במטרה היומית, רק עם המחווה הזו, נכון?
נתונים: CO2 (44 גרם למול); Ç4ה10 (58 גרם למול).
א) 0.25 ק"ג.
ב) 0.33 ק"ג.
ג) 1.0 ק"ג.
ד) 1.3 ק"ג.
ה) 3.0 ק"ג.
פתרון הבעיה:
הנתונים שמסרו התרגיל היו:
מסת טוחנת CO2 = 44 גרם למול
מסת טוחנת C4ה10 = 58 גרם / מול
1 ק"ג CO2 מסולק על ידי אדם
מסה של גז בוטאן שלא יישרף עוד בק"ג =?
1או שלב: להרכיב ולאזן את משוואת הבעירה של בוטאן (C4ה10)
1C4ה10 + 8 O2 → 4 CO2 + 5 שעות2או
2או שלב: הרכיב את הכלל של שלושה מהחישוב הסטויוכיומטרי, שיכלול רק את המוני בוטאן ופחמן דו חמצני:
1C4ה10 → 4 CO2
1.58 גרם 4. 44 גרם
x1 ק"ג
176.x = 58
x = 58
176
x = 0.33 ק"ג גז בוטאן
על ידי. דיוגו לופס דיאס