המספר האטומי, המסומל באות Z, תואם את כמות הפרוטונים הקיימים בגרעין האטום של יסוד כימי נתון. לדוגמא, מספר האטום של מימן הוא 1, כלומר יש לו רק פרוטון אחד בגרעין האטום שלו.
המספר האטומי מופיע בדרך כלל לצד סמל המחתר של היסוד הכימי (בפינה התחתונה) משמאל. דוגמא: 1ח.
במצב הקרקע, המספר האטומי שווה למספר האלקטרונים, שכן במצב זה היסוד הוא נייטרלי, לכן כמות המטענים החיוביים (פרוטונים) חייבת להיות שווה לכמות המטענים השליליים (אלקטרונים) של אָטוֹם.
המספר האטומי חשוב מכיוון הוא זה שקובע את המאפיינים והתכונות העיקריים של היסוד, כמו גם את התנהגותו ומיקומו בטבלה המחזורית. היסודות רשומים בטבלה המחזורית בסדר עולה של מספר האטום, המופיע בדרך כלל מעל היסוד, כפי שמוצג להלן. שימו לב שהיסוד הראשון הוא מימן, H (Z = 1), ואחריו הליום, He (Z = 2), ואז מגיע ליתיום, Li (Z = 3) וכן הלאה.
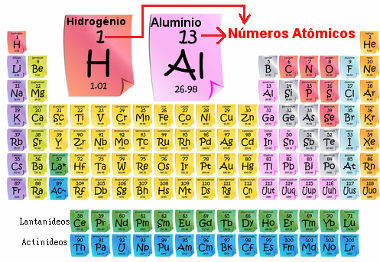
מספר אטומי של אלמנטים בטבלה המחזורית
אנו יכולים אפילו להמשיג אלמנט כימי כהוויה "קבוצה של אטומים בעלי מספר אטומי זהה". לפיכך, כאשר אנו מדברים, למשל, על היסוד הכימי חמצן, אנו מדברים על אטומים בעלי מספר אטומי 8. להלן יש את האטומים של היסודות הכימיים מתקופות 1 ו -2 בטבלה המחזורית בסדר עולה של מספר האטום:

יסודות כימיים מתקופות 1 ו -2 בטבלה המחזורית בסדר עולה של מספר האטום
המספרים האטומיים הוגדרו בתחילה על ידי הפיזיקאי האנגלי הנרי גווין ג'פריס מוזלי (1887-1915) וכאשר ביצעו ניסויים הכרוכים בהפצצת אלמנטים שונים כימאים עם צילומי רנטגן, הוא הבחין כי השורש הריבועי של תדירות צילומי הרנטגן המיוצרים על ידי פליטת גרעין האטום פרופורציונלי ישירות למספר האטומי של היסוד בטבלה. תְקוּפָתִי. בכך הוא הגיע למסקנה שהמספר האטומי קשור לתכונות האטומים מכיוון שהוא מייצג את מספר המטענים החיוביים בגרעין של כל אטום.
קשרים כימיים אינם משפיעים על מספר האטומים של האטומים, מכיוון שהם כוללים רק אלקטרונים שנמצאים באלקטרוספרה. עם זאת, תגובות גרעיניות מערבות את גרעין האטום ומכאן גם המספר האטומי נכלל.
לדוגמא, כאשר חלקיקים (בעיקר נויטרונים מתונים) מופגזים על גרעין אטום כבד ולא יציב, גרעין זה הוא שבור ומוליד שני גרעינים אטומיים קטנים יותר, כלומר עם מספר קטן יותר של פרוטונים ונויטרונים, המשחררים כמות ענקית של אֵנֶרְגִיָה.
היתוך גרעיני, לעומת זאת, הוא התהליך ההפוך, כאשר שני גרעינים קטנים וקלילים מתאחדים, שמקורם בגרעין גדול ויציב יותר, ומשחרר כמות גדולה עוד יותר של אנרגיה.
לפיכך, בכל פעם שתגובות גרעיניות אלה מתרחשות, מקורם של יסודות כימיים חדשים, שכן המספרים האטומיים של היסודות הראשוניים שונים מהמספרים האטומיים של היסודות הסופיים. לדוגמא, ראה להלן כי ביקוע של אורניום -235 עם מספר אטומי 92 מוליד בריום (Z = 56), קריפטון (Z = 36) ושלושה נויטרונים:

תגובת ביקוע גרעינית לאורניום 235
מאת ג'ניפר פוגאצה
בוגר כימיה
מָקוֹר: בית ספר ברזיל - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-numero-atomico.htm
