Uno soluzione tampone è una miscela utilizzata per evitare che il pH o pOH del mezzo cambi quando vengono aggiunti acidi o basi forti.
Esistono due tipi di soluzione tampone:
1. Miscela di acido debole con la sua base coniugata;
2. Miscela di base debole con il suo acido coniugato.
Diamo un'occhiata ad esempi di ciascuno e di come funzionano quando viene aggiunta una piccola quantità di acido o base forte al mezzo:
1. Miscela di acido debole con la sua base coniugata:
Per formare una tale soluzione, l'acido debole viene miscelato con un sale dello stesso anione dell'acido.
Ad esempio, si consideri una soluzione tampone costituita da acido acetico (H3CCOOH(Qui)) e acetato di sodio (H3CCOONa(S)). Vedi che entrambi hanno l'anione acetato: (H3CCOO-(Qui)). La concentrazione di questi ioni è praticamente dovuta alla dissociazione del sale, che è grande. La ionizzazione acida è piccola.

Nota ora cosa succede nelle seguenti possibilità di addizione:
- Aggiunta di una piccola quantità di acido forte:
L'aggiunta di un acido forte aumenta la concentrazione dello ione idronio, H
3oh+1, e poiché l'acido acetico è un acido debole, l'anione acetato ha un'elevata affinità per il protone (H+) idronio. In questo modo reagiscono e si forma più acido acetico:
Di conseguenza, il pH del mezzo praticamente non cambia. Tuttavia, se viene aggiunto un acido sempre più forte, verrà il momento in cui tutto l'anione acetato verrà consumato e l'effetto tampone cesserà.
- Aggiunta di una piccola quantità di base forte:
L'aggiunta di una base forte aumenta la concentrazione di ioni OH-. Ma questi ioni sono neutralizzati dagli ioni H3oh+1 rilasciato nella ionizzazione dell'acido acetico:

Con questa reazione, la concentrazione di ioni H3oh+1(Qui) diminuirà e ci sarà uno spostamento dell'equilibrio verso l'aumento della ionizzazione acida e, quindi, la variazione del pH della soluzione sarà molto piccola. La concentrazione di ioni H3oh+1(Qui) sarà praticamente costante.
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
In questo caso esiste anche una capacità limite del buffer. Pertanto, se aggiungiamo sempre più base, l'equilibrio della ionizzazione acida si sposterà sempre più verso la sua ionizzazione, fino a consumare tutto l'acido.
2. Miscela di una base debole con il suo acido coniugato:
Questo tipo di soluzione tampone è costituito da una base debole e da una soluzione salina che contengono lo stesso catione della base.
Ad esempio, si consideri una soluzione tampone formata da idrossido di magnesio, MgOH2(ac) (base debole) e cloruro di magnesio, MgCl2(i) (sale). Entrambi contengono il catione magnesio (Mg2+(Qui)). Gli ioni magnesio presenti nel mezzo sono praticamente tutti derivati dalla dissociazione del sale, essendo debole la dissociazione della base:
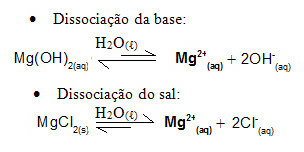
- Aggiunta di una piccola quantità di acido forte:
In questo caso, gli ioni H3oh+1 proveniente dall'aggiunta di acido forte sarà neutralizzato dagli ioni OH-, proveniente dalla dissociazione di basi deboli. Questo sposterà l'equilibrio di dissociazione di base a destra.
Pertanto, la variazione del pH (se presente) sarà molto piccola, poiché la concentrazione di ioni OH- rimane costante. L'effetto tampone cesserà quando l'intera base sarà dissociata.
- Aggiunta di una piccola quantità di base forte:
La base forte aggiunta subisce la dissociazione rilasciando ioni OH-. Poiché l'idrossido di magnesio è una base debole, il magnesio rilasciato per dissociazione dal sale avrà una maggiore tendenza a reagire con l'OH-:

Pertanto, l'aumento degli ioni OH- è compensato dall'aumento proporzionale di Mg(OH)2(ac). Di conseguenza, il pH non subisce grandi cambiamenti.
Questo effetto termina quando tutto il catione magnesio è stato consumato.
di Jennifer Fogaça
Laureato in Chimica
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
FOGAÇA, Jennifer Rocha Vargas. "Cos'è una soluzione tampone?"; Brasile Scuola. Disponibile in: https://brasilescola.uol.com.br/quimica/o-que-uma-solucao-tampao.htm. Consultato il 28 giugno 2021.
Chimica

Metti alla prova le tue conoscenze e impara di più con questo elenco di esercizi risolti sugli equilibri chimici. Attraverso questo materiale, sarai in grado di capire meglio come lavorare le costanti di equilibrio (Kp, Kc e Ki), lo spostamento dell'equilibrio, il pH e il pOH, nonché l'equilibrio nelle cosiddette soluzioni tampone.
Soluzione, Soluzione Solida. Soluzione liquida, soluzione gassosa, soluzioni formate da gas e liquido, soluzioni formate da liquidi.