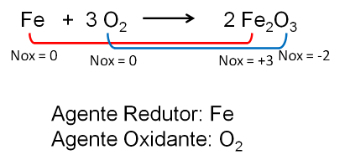
Gli studenti delle scuole superiori sono sempre soggetti ad affrontare reazioni redox con ioni, sia negli esami di ammissione che nell'Esame Nazionale di Scuola Superiore (Enem). Pertanto, bilanciare queste equazioni può essere un argomento molto temuto.
Al fine di facilitare la comprensione di questo argomento, questo testo cerca di affrontare il bilanciamento delle equazioni redox con gli ioni con la descrizione di alcuni passaggi per realizzarlo. Per questo, dobbiamo iniziare identificando questo tipo di reazione chimica.
A reazioni redox con ioni sono individuati dalla presenza di uno o più componenti con carica (positiva o negativa), cioè il ioni (cationi o anioni), che possono essere presenti nei reagenti o nei prodotti, come nei due esempi a Seguire:
1° Esempio:Cr2oh72- + Fe2+ + H+ → Cr3+ + Fe3+ + H2oh
2° Esempio:Cl2 + C + H2O → CO2 + H+ + Cl-
Per effettuare il equazioni di bilanciamento delle reazioni redox con ioni, è fondamentale seguire alcuni passaggi, quali:
1° passo: determinare il NOX di ciascuno degli atomi dei reagenti e prodotti dell'equazione;
2° Passo: verifica quale specie ha sofferto ossidazione;
3° Step: determinare la variazione del NOX la specie che ha subito l'ossidazione;
4° Fase: moltiplicare la variazione riscontrata nella terza fase per il numero di atomi della specie ossidante;
5° Step: verifica quale specie ha sofferto riduzione;
6° Step: determinare la variazione di NOX della specie che ha subito la riduzione;
7° Fase: moltiplicare la variazione riscontrata nella terza fase per il numero di atomi della specie che riduce;
8° Step: utilizzare il valore trovato nel quarto step come coefficiente della specie che si riduce;
9° Stadio: utilizzare il valore trovato nel settimo passaggio come coefficiente della specie ossidante;
10° Step: inserire i coefficienti nelle altre specie, secondo il metodo di bilanciamento di prova. In quelle specie in cui non è possibile farlo, inserire come coefficienti le incognite;
11° Fase: moltiplicare il coefficiente di ciascuna specie per il suo carico;
12° Passo: Equalizzare la somma delle cariche dei reagenti con quella dei prodotti per trovare il coefficiente di una delle specie con incognite;
13° Step: finalizzare l'equilibratura con il metodo di prova.
Per facilitare la comprensione, seguire la procedura descritta sopra, nel seguente esempio di a equazione redox con ioni:

Equazione ionica che mostra alcuni ioni e gruppi di carica generali 0
1° passo: NOX di ogni atomo.

NOX di atomi presenti nell'equazione
2° passo: Specie che subiscono l'ossidazione.

Specie che subiscono ossidazione nell'equazione
Man mano che il NOX dello iodio aumenta da -1 a 0 da reagente a prodotto, è quindi la specie che subisce l'ossidazione.
3° Passo: Determinare la variazione di NOX delle specie ossidate.
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
Per farlo basta sottrarre il NOX più alto per il NOX più basso:
∆NOX = (0) – (-1)
∆ NOX = 0 + 1
∆ NOX = 1
Passaggio 4: Moltiplicazione NOX per quantità.
In questo passaggio, moltiplichiamo la variazione trovata nel terzo passaggio per il numero di atomi della specie.
io- = ∆NOX.1
io- = 1.1
io- = 1
5° passo: Specie che subiscono riduzione.

Specie che subiscono una riduzione nell'equazione
Poiché il cromo NOX diminuisce da +7 a +3 da reagente a prodotto, è quindi la specie che subisce la riduzione.
6° passo: Determinare la variazione di NOX della specie ridotta.
Per farlo basta sottrarre il NOX più alto per il NOX più basso:
∆NOX = (+6) – (+3)
∆ NOX = +6 – 3
∆ NOX = 3
7° passo: Moltiplicazione NOX per quantità.
In questo passaggio, moltiplichiamo la variazione trovata nel sesto passaggio per il numero di atomi della specie.
Cr2oh72- = ∆NOX.1
Cr2oh72- = 3.2
Cr2oh72- = 6
8° passo: Inizia a bilanciare.
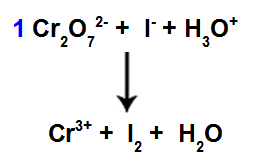
Inizio del bilanciamento utilizzando il coefficiente trovato
In questa fase iniziamo il bilanciamento ponendo il coefficiente trovato nella quarta fase nella specie che ha subito la riduzione.
9° Passo: Continua a bilanciare.

Continuazione del bilanciamento utilizzando il coefficiente trovato
10° passo: Usa il metodo di prova.
Ci sono 6 atomi di I nel reagente, quindi dobbiamo mettere il coefficiente 3 nella specie I2 del prodotto, perché contiene solo 2 atomi di Cl;
Come nella specie 1, Cr2oh72-, ci sono 2 atomi di Cr, dovremmo mettere il coefficiente 2 nella specie Cr3+ di prodotto.
Poiché abbiamo ossigeno in tre specie, e in due di esse non ci sono coefficienti, per mantenere l'equilibrio, dobbiamo inserire incognite nelle restanti specie:
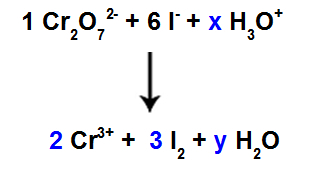
Coefficienti dopo aver utilizzato il metodo di prova
11° passo: Moltiplicazione di ciascuna specie per il suo carico.
Per fare ciò, basta moltiplicare il coefficiente della specie per il suo carico, come segue:
Nei reagenti:
Cr2oh72- = 1.(-2) = -2
io- = 6.(-1) = -6
H3oh+ = x.(+1) = +x
Sui prodotti:
Cr3+ = 2.(+3) = +6
io2 = 4.0 = 0
H2O = y.0 = 0
12° passo: Somma delle spese.
In questo passaggio, dobbiamo aggiungere i carichi di reagenti e prodotti trovati nel passaggio 11:
Reagenti = prodotti
-2 + (-8) + (+x) = +6 + 0 + 0
-2 - 6 + x = 6
-8 + x = 6
x = 6 + 8
x = 14
13° passo: Fine del bilanciamento.
Per completare il bilanciamento, dobbiamo:
Metti il risultato trovato nel 12° passaggio nella specie H3oh+;
Poiché ora abbiamo 42 atomi di H nel reagente, è necessario inserire il coefficiente 21 nella specie H2Il nel prodotto.
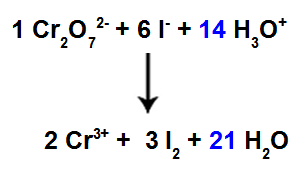
Equazione di reazione ionica bilanciata
Di Me. Diogo Lopes Dias
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
GIORNI, Diogo Lopes. "Reazioni di riduzione del rosso con ioni"; Brasile Scuola. Disponibile in: https://brasilescola.uol.com.br/quimica/reacoes-oxirreducao-com-ions.htm. Consultato il 28 giugno 2021.