voi saponi e il detersivi servono per rimuovere lo sporco e soprattutto il grasso dai materiali. Ma qual è la differenza tra i due? C'è più vantaggio nell'usare sapone o detersivo? E l'ambiente? Quale inquina di meno?
Diamo un'occhiata alla struttura di ognuno, per arrivare a una risposta soddisfacente.
I saponi hanno la seguente struttura tipica:
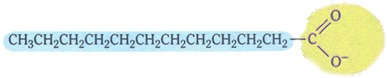
Struttura tipica dei saponi.
Si noti che ha una parte apolare, rappresentata dal colore blu, che interagisce con grasso e olio, anch'essi apolari; e ha una parte polare (in giallo), che interagisce con l'acqua.
La struttura dei detersivi ha anche una parte polare e una non polare, come si può vedere di seguito:
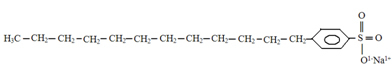
Struttura tipica dei detersivi.
Il punto su cui vogliamo porre l'attenzione, e che si può osservare confrontando le due strutture, è che i detergenti più comuni sono sali derivati dall'acido solforico (H2SOLO4), che è un acido forte e porta più danni all'ambiente. Si ha quindi la presenza di zolfo (S) nella struttura del detergente. La materia prima base dei detersivi è il Petrolio, che è una risorsa energetica fossile non rinnovabile.
Inoltre, il caso mostrato sopra è un detergente biodegradabile, ma ci sono alcuni detergenti, che sono quelli che hanno ramificazioni nella loro struttura, che non sono biodegradabili, oppure cioè non vengono degradati da microrganismi e se scaricati in fiumi e laghi possono provocare gravi effetti ambientali con conseguente morte di vari pesci, alghe, insetti e uccelli acquatico.
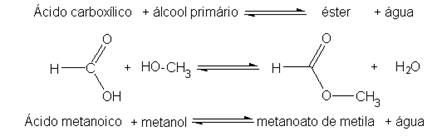
I saponi sono costituiti da oli o grassi che reagiscono con una base forte, come idrossido di sodio (NaOH). Quindi i saponi sono sali di acido carbossilico, che sono acidi deboli. Nella struttura di questi saponi, l'idrogeno del gruppo carbossilico (─COOH) è sostituito da ioni sodio (Na+), potassio (K+) o ammonio (NH4+), come mostrato di seguito. Il risultato è che tutti i saponi sono biodegradabili.
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
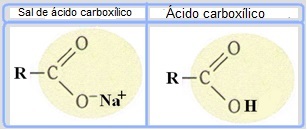
I saponi sono sali di acidi carbossilici in cui l'idrogeno nell'acido è sostituito da un catione.
Un altro aspetto negativo dei detersivi è che molti di essi contengono ioni fosfato nella sua struttura. Questi ioni sono usati dalle alghe come nutrienti, quindi con questi detergenti che vengono scaricati dump nei fiumi, i loro ioni fosfato sono aumentati drasticamente e queste alghe si moltiplicano in gran numero. scala. Questo processo si chiama eutrofizzazione e provoca la morte di pesci e altri esseri viventi acquatici, in quanto le alghe ricoprono le superfici dei laghi, impedendo l'ingresso di luce e ossigeno nell'acqua.
Così, se guardiamo alla questione ambientale, la saponetta è l'opzione migliore.

Le fioriture algali eccessive sono chiamate eutrofizzazione.
Ma per quanto riguarda l'efficienza?
Ebbene, i saponi hanno uno svantaggio quando la pulizia viene effettuata con acqua che contiene cationi di calcio, magnesio e ferro, come gli anioni nei saponi possono reagire con questi cationi, dando origine a composti insolubili, che precipitano e formano la cosiddetta acqua difficile. Di conseguenza, i saponi non possono rimuovere sporco e grasso.
I detersivi, invece, hanno il vantaggio rispetto ai saponi che non reagiscono mai con i cationi in acqua dura e quindi puliscono indipendentemente dall'acqua utilizzata.
Jennifer Fogaçaga
Laureato in Chimica
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
FOGAÇA, Jennifer Rocha Vargas. "Sapone X detergente"; Brasile Scuola. Disponibile in: https://brasilescola.uol.com.br/quimica/sabao-x-detergente.htm. Consultato il 28 giugno 2021.
Chimica

Sostanze sintetiche, metilene-dimetossi-metamfetamina, sostanza fortemente psicoattiva, ecstasy, MDMA, saccarina, ciclamato, plastica, acrilico, detergenti, gomma naturale, gomme organiche, gomma sintetica, idrocarburi sintetici, puleggia