
La quantità di calorie dipende dalla costituzione del cibo. Quindi, per determinare sperimentalmente la quantità di calore sprigionata dal cibo e che può essere assorbita dall'organismo, utilizziamo un dispositivo chiamato calorimetro.
Questo dispositivo misura il calore rilasciato dal cibo quando viene bruciato. Esistono diversi tipi di calorimetro; il primo di essi è stato creato nel 1780 da Lavoisier e Laplace ed è stato un calorimetro del ghiaccio.
Al giorno d'oggi, il più utilizzato e che tiene conto del concetto calorico spiegato sopra è il calorimetro ad acqua. Questo dispositivo è rivestito con un materiale isolante per evitare perdite di calore dal mezzo; e il cibo da analizzare viene posto nella Camera di combustione, che contiene ossigeno gassoso e elettrodi. Questi elettrodi subiscono una scarica elettrica e provocano la loro accensione e combustione degli alimenti.
La massa nota di acqua contenuta nel calorimetro assorbe il calore ceduto dal cibo bruciato e a termometro misura l'aumento della temperatura dell'acqua. Inoltre, il calorimetro contiene a
agitatore che permette alla temperatura dell'acqua di rimanere uniforme in tutta la sua interezza.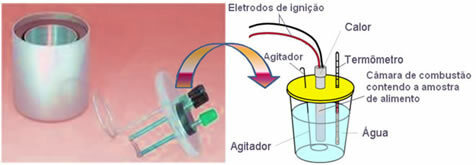
Quindi, se usiamo, ad esempio, una massa di 1 grammo di zucchero e il calorimetro ha 1000 g di acqua, e osserviamo che alla fine della reazione, la temperatura dell'acqua è passata da 20°C a 24°C, cioè è aumentata di 4°C, si può quindi raggiungere il valore energetico del zucchero. Piace? Bene, considerando il concetto calorico iniziale, abbiamo:
| Alzare da 1°C → 1 cal per grammo d'acqua |
| Alzare da 4°C → 4 cal per grammo di acqua |
Quindi 1 g di acqua assorbe 4 lime. Tuttavia sono stati utilizzati 1000 g di acqua e, considerando che tutto il calore rilasciato nella combustione è stato assorbito da essa, l'energia totale assorbita dall'acqua è stata di 4000 cal o 4 kcal. Pertanto, concludiamo che:
| Il valore energetico dello zucchero = 4000 cal/g o 4 kcal/g. |
Trasformando in SI:
1 kcal 4,18 kJ
4 kcal/g x
x = 16,72 kJ/g
Inoltre, possiamo usare la seguente equazione per calcolare la quantità di calore ceduto o assorbito dall'acqua:
| Q = m. ç. t |
Dove:
Q = calore ceduto o assorbito dall'acqua;
m = massa d'acqua;
c = calore specifico dell'acqua, che equivale a 1.0 cal/g. °C o 4,18 J/g. °C;
Δt = variazione della temperatura subita dall'acqua, che è data dalla diminuzione della temperatura finale di quella iniziale (tf – tio).
Usando questa formula otteniamo lo stesso risultato:
Q = m. ç. t
Q = 1000 gr. 1,0 cal/g. °C. (24-20)°C
Q=4000 cal
Q = 4.0 kcal
o
Q = m. ç. t
Q = 1000 gr. 4,18 kJ/g. °C. (24-20)°C
Q= 16,72 kJ
di Jennifer Fogaça
Laureato in Chimica
Fonte: Scuola Brasile - https://brasilescola.uol.com.br/quimica/medindo-as-calorias-dos-alimentos-por-meio-um-calorimetro.htm

